
【题目】在如图装置中,若关闭活塞,则品红溶液无变化,石蕊试液变红,澄清石灰水变浑浊;若打开活塞,则品红溶液褪色,石蕊试液变红,澄清石灰水变浑浊。据此判断气体和广口瓶中盛放的物质是( )
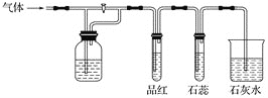
A. 二氧化硫和浓硫酸
B. 二氧化硫和碳酸氢钠溶液
C. 氯气和氢氧化钠溶液
D. 二氧化碳和氢氧化钠溶液
【答案】B
【解析】
若关闭活塞,则品红溶液无变化,说明气体经过洗气瓶后的气体应该是不具有漂白性的气体,能石蕊溶液变红,石灰水变浑浊,说明原气体可能为CO2或SO2;打开活塞后品红褪色,石蕊试液变红,石灰水变浑浊,说明该气体具有漂白性、酸性,说明原气体可能含有SO2;以此解答该题。
A.若关闭活塞,二氧化硫气体通过浓硫酸后,得到干燥的二氧化硫气体,能够使品红溶液褪色,不符合题给实验操作现象,故A错误;
B.若关闭活塞,二氧化硫和碳酸氢钠溶液反应生成二氧化碳,二氧化碳不具有漂白性,不能使品红溶液褪色,但能使石蕊试液变红,石灰水变浑浊;打开活塞,则二氧化硫能够使品红溶液褪色,石蕊试液变红,石灰水变浑浊,符合题给实验操作现象,故B正确;
C.若关闭活塞,氯气和氢氧化钠溶液反应,被完全吸收没有气体溢出,后面的实验不能完成;若打开活塞,则品红溶液褪色,石蕊试液先变红后褪色,澄清石灰水不变浑浊,不符合题给实验操作现象,故C错误;
D.若关闭活塞,二氧化碳和氢氧化钠溶液反应,被完全吸收没有气体溢出,后面的实验不能完成;若打开活塞,二氧化碳不能使品红溶液褪色,不符合题给实验操作现象;故D错误;
故答案选B。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】含MgCl2、AlCl3均为nmol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是(离子(或物质)沉淀pH见表)
离子 | Mg2+ | Al3+ | 物质 | Al(OH)3 |
开始沉淀时的pH | 8.93 | 3.56 | 开始溶解时的pH | 8.04 |
完全沉淀时的pH | 10.92 | 4.89 | 完全溶解时的pH | 12.04 |
A. 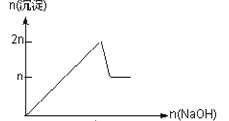
B. 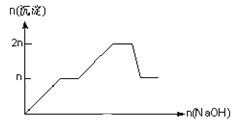
C. 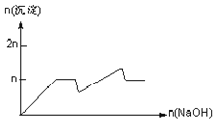
D. 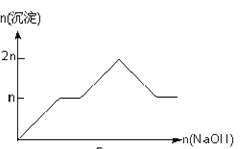
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:

请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有______(填离子符号)。
(2)操作②中反应的离子方程式:__________________________________。
(3)操作③中反应的离子方程式:__________________________________。
(4)操作④中一系列处理的操作步骤:过滤、______、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______g。(用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。
请回答下列问题:
(1)X、Y的元素符号依次是 _________、_________。
(2)XZ2与YZ2分子的立体构型分别是______________和_______________,相同条件下两者在水中的溶解度较大的是____________(写分子式)。
(3)Q的元素名称是_________,它在元素周期表中的位置是_________________,它的核外电子排布式为____________________,在形成化合物时它的最高化合价为___________。
(4)Y、Z、E三种元素原子的第一电离能由大到小的顺序是____________。(用元素符号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填写下列空格。
(1)写出镍(Ni)的基态原子核外电子排布式__________________________。
(2)画出氮(N)原子价电子的电子排布图___________________________。
(3)CH≡CCH(CH3)2系统命名法命名为______________________。
(4)2,3-二甲基-1-丁烯的结构简式为___________________________。
(5)支链只有一个乙基且式量最小的烷烃的结构简式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知32 g甲醇燃烧生成二氧化碳和液态水放出的热量为725. 76 kJ,若上述过程生成的水为气态,则放出的热量________(填“大于”“小于”或“等于”) 725.76kJ。
(2)生产甲醇的原料 CO 和 H2来源于CH4(g)+H2O (g)CO(g)+3H2(g)△H > 0,100℃时,将1 mol CH4和2 mol H2O通入容积为1L的定容密封容器中,发生上述反应。
①能说明该反应已达到平衡状态的是________(填字母代号)。
a.容器内气体密度恒定
b.单位时间内消耗0.1mol CH4的同时生成0.3mol H2
c.容器内的压强恒定
d.3v正(CH4) = v 逆(H2)
②如果反应开始至 5 min 后达到平衡 ,且平衡时CH4 的转化率为 50%,则从开始到平衡这段时间内用比表示的反应速率为___________。
(3)近几年开发的甲醇燃料电池采用作铂电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理示意图如图所示:
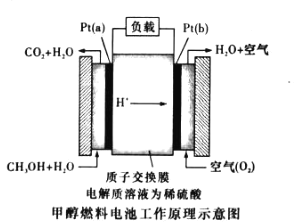
①P t (a)电极是电池的________极,电极反应式为_____________ 。
②如果该电池工作时电路中通过1.806×1023个电子,则消耗 CH3OH___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是探究发生腐蚀的装置图。发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升。下列说法不正确的是

A. 两种腐蚀负极的电极反应式均为Fe-2e-=Fe2+
B. 开始时发生的是析氢腐蚀
C. 一段时间后发生的是吸氧腐蚀
D. 析氢反应的总反应式为2Fe+O2+2H2O=2Fe(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、钾是农作物生长的必须营养元素,磷和钙都是促成骨骼和牙齿的钙化不可缺少的营养元素。回答下列问题:
(1)基态K的核外电子排布式为____________,基态N的价电子排布图为____________。
(2)元素的第一电离能:Ca________(填“>”或“<”)P。
(3)白磷P4在CS2中的溶解度________(填“大于”或“小于”)在水中的溶解度,N4是氮的一种新型单质,若N4分子结构类似于白磷P4,则N的杂化方式为________。
(4)下表是几种碳酸盐的热分解温度和阳离子半径:
碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 900 | 1172 | 1360 |
阳离子半径/pm | 99 | 112 | 135 |
根据上表数据分析碳酸钡分解温度最高的原因是_______________________
(5)常温下PCl5是一种白色晶体,晶体结构为氯化铯型,由A、B两种离子构成。已知A、B两种离子分别与CCl4、SF6互为等电子体,则A、B两种离子的符号分别为________、________。
(6)用晶体的X射线衍射法可以测得阿伏加德罗常数的值。已知金属钙的晶胞为面心立方(如图)晶胞,晶胞边长为d pm;又知钙的密度为ρ g/cm3,则一个钙晶胞的质量为________(用d、ρ表示,下同)g,阿伏加德罗常数的值为______________(化成最简式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从废定影液[含Ag(S2O3)23-和Br-等]中回收Ag和Br2的主要步骤为:向废定影液中加入Na2S溶液沉淀银离子,过滤、洗涤、干燥,灼烧Ag2S制取金属Ag;制取C12并将Cl2通入滤液中氧化Br-,再用苯萃取分液。其中部分实验操作的装置如下图所示:

下列叙述正确的是
A. 用装置甲分离Ag2S时,用玻璃棒不断搅拌
B. 用装置乙在通风橱中高温灼烧Ag2S制取Ag
C. 用装置丙制备用于氧化过滤液中Br-的Cl2
D. 用装置丁分液时,先放出水层再换个烧杯继续放出有机层
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com