
【题目】X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。
请回答下列问题:
(1)X、Y的元素符号依次是 _________、_________。
(2)XZ2与YZ2分子的立体构型分别是______________和_______________,相同条件下两者在水中的溶解度较大的是____________(写分子式)。
(3)Q的元素名称是_________,它在元素周期表中的位置是_________________,它的核外电子排布式为____________________,在形成化合物时它的最高化合价为___________。
(4)Y、Z、E三种元素原子的第一电离能由大到小的顺序是____________。(用元素符号表示)
【答案】S C V形 直线型 SO2 铬 第四周期VIB族 1s22s22p63s23p63d54s1或[Ar]3d54s1 +6 F>O>C
【解析】
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,则X为S元素;Y原子核外的L层电子数是K层的两倍,为C元素;Z是地壳内含量(质量分数)最高的元素,为O元素;Q的核电荷数是X与Z的核电荷数之和,为Cr元素;E在元素周期表的各元素中电负性最大,为F元素。
由分析知:X为S元素、Y为C元素、Z为O元素、Q为Cr元素、E为F元素;
(1)X、Y的元素符号依次是S、C;
(2) XZ2与YZ2分子分别是SO2与CO2分子,SO2分子中S原子价层电子对个数是2+![]() =3,其中含有1个孤电子对,则为sp2杂化,立体构型是V形;CO2分子中C原子价层电子对个数是2+
=3,其中含有1个孤电子对,则为sp2杂化,立体构型是V形;CO2分子中C原子价层电子对个数是2+![]() =2,不含孤电子对,则为sp杂化,立体构型是直线形;SO2是极性分子,CO2是非极性分子,根据相似相溶原理可知SO2在水中溶解度较大;
=2,不含孤电子对,则为sp杂化,立体构型是直线形;SO2是极性分子,CO2是非极性分子,根据相似相溶原理可知SO2在水中溶解度较大;
(3) Q为铬元素,位于第四周期第VIB族;其原子核外有24个电子,根据构造原理该原子核外电子排布式为1s22s22p63s23p63d54s1,价电子排布式为3d54s1,则在形成化合物时它的最高化合价为+6价;
(4)C、O、F为同周期主族元素,随核电荷数增大,元素原子的第一电离能呈增大趋势,则三种元素原子的第一电离能由大到小的顺序是F>O>C。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】2019年10月1日是中华人民共和国成立70周年,国庆期间对大量盆栽鲜花施用了S-诱抗素制剂以保证鲜花盛开,S-诱抗素的分子结构简式如图。下列关于该物质的说法正确的是
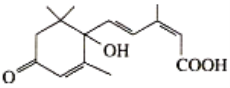
A.该有机物的分子式为C15H20O4
B.该有机物能发生取代、加成和水解反应
C.1mol的该有机物与足量的钠反应产生2molH2
D.1mol该有机物含有4mol双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为短周期主族元素,原子序数依次增大,X原子的最外层电子数是第一层电子数的2倍,Y的气态氢化物与最高价氧化物的水化物可形成盐,Z的最外层电子数与其电子总数比为3:8,下列说法正确的是![]()
A.X、Y、W的最高价含氧酸酸性顺序:![]()
B.Z、W可形成![]() 的化合物,属于离子化合物
的化合物,属于离子化合物
C.离子半径:![]()
D.气态氢化物的稳定性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:甲、乙、丙、丁为常见化合物,A、B为单质,相互转化关系如图。其中甲是天然气的主要成分。回答下列问题:
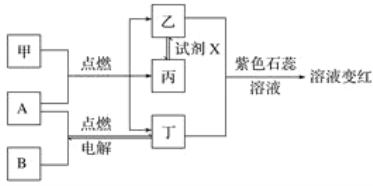
(1)丁物质的名称:______,丙物质的化学式:_________________________________________。
(2)检验化合物乙的化学方程式:___________________________________________________。
(3)试剂X可能的化学式:________、________(要求:所选物质类别不同)。
(4)通过分析表明:燃料充分燃烧的条件之一是______________________________。
(5)取变红溶液于试管中加热,观察到的现象有_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物YX2、ZX2中,X、Y、Z的核电荷数小于18;X原子最外能层的p能级中有一个轨道充填了2个电子,Y原子的最外层中p能级的电子数等于前一能层电子总数,且X和Y具有相同的电子层;Z与X在周期表中位于同一主族。回答下列问题:
(1)X的价电子排布式为____________,Y的电子排布图为___________;
(2)ZX2的分子式是________________,VSEPR模型名称为________________。YX2的电子式是______________,中心原子发生了________杂化。
(3)Y与Z形成的化合物的分子式是_______________。Y的氢化物中分子构型为正四面体的是_________(填名称),键角为______________,中心原子的杂化形式为_________。
(4)X的氢化物的沸点比同主族其他元素形成的氢化物沸点高,原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图装置中,若关闭活塞,则品红溶液无变化,石蕊试液变红,澄清石灰水变浑浊;若打开活塞,则品红溶液褪色,石蕊试液变红,澄清石灰水变浑浊。据此判断气体和广口瓶中盛放的物质是( )
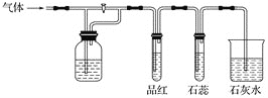
A. 二氧化硫和浓硫酸
B. 二氧化硫和碳酸氢钠溶液
C. 氯气和氢氧化钠溶液
D. 二氧化碳和氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水三氯化铬(CrCl3)为紫色晶体,在工业上主要用作媒染剂和催化剂,某化学小组用Cr2O3和CCl4在高温下制备无水三氯化铬,部分实验装置如图所示。
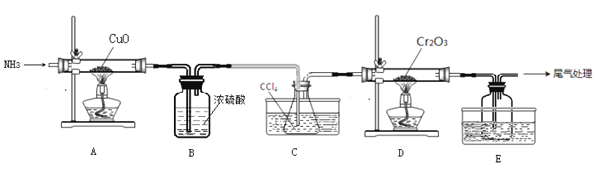
已知:①CrCl3熔点为83℃,易潮解,易升华,易溶于水但不易水解,高温下易被氧气氧化;②Cr2O3和CCl4在高温下反应的产物为CrCl3和光气(COCl2 )。请回答下列问题:
(1)装置A是氮气制备装置,氮气的作用是____________。
(2)装置B的作用为________。装置C和装置E的水槽中应分别盛有__________、____________。
(3)装置D中生成CrCl3和光气(COCl2 )的化学方程式为_________。
(4)该实验装置有设计不合理的地方,请写出改进方法:_________(写一点即可)
(5)产品中CrCl3质量分数的测定:
(i)称取0.3000 g得到的CrCl3样品溶于水并于250mL容量瓶中定容。
(ii)取25.00mL样品溶液于带塞的锥形瓶中,加热至沸腾后加入稍过量的Na2O2,稀释并加热煮沸,再加入过量的H2SO4酸化,将Cr3+氧化为Cr2O72-;再加入过量的KI固体,加塞摇匀,使铬完全以Cr3+形式存在
(iii)加入1mL指示剂,用0.0250 mol·L-1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL(已知2Na2S2O3+I2= Na2S4O6+2NaI)
①ii中加入稍过量的Na2O2后要加热煮沸,其主要原因是____________;加入KI发生反应的离子方程式为________________
②滴定实验可选用的指示剂为____________产品中CrCl3质量分数为_______%(结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下浓度为0.1mol/L的几种溶液的pH如右下表。下列有关说法正确的是( )
溶质 | pH |
NaF | 7.5 |
Na2CO3 | 11.6 |
NaClO | 9.7 |
NaHCO3 | 8.3 |
A. 同温度同浓度下,酸由强到弱的顺序为:HF>H2CO3>HClO
B. 水解方程式:F-+H2O![]() HF+OH-的平衡常数为1×10-13
HF+OH-的平衡常数为1×10-13
C. 将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L
D. 等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(HF)>c(Na+)>c(F-)>c (H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com