
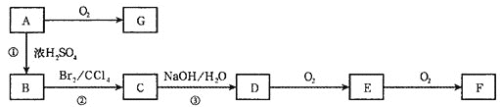
����Ŀ����ͼ��ʾ��A��B��C��D��E��F��G��Ϊ�л������֮��������ת����ϵ(���ֲ���ͷ�Ӧ��������ȥ)����֪B�����к��б������������ܶ���ͬ��ͬѹ��H2�ܶȵ�59����1molB�����Ժ�4molH2�����ӳɷ�Ӧ��B�ı����ϵ�һ����ԭ�ӱ�����ȡ�����õIJ��������֡�E��G���ܹ�����������Ӧ��F�����к����ǻ����Ȼ�����һ�������¿��Ծۺ����ɸ߷��ӻ����
��ش��������⣺
(1)A�Ľṹ��ʽ____________��
(2)��Ӧ�ٵķ�Ӧ������________��
(3)E��������Һ��Ӧ�Ļ�ѧ����ʽΪ_______��
(4)�����ʵ�����A��F����������Ӧ���������л���Ľṹ��ʽΪ________��
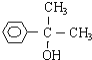
(5)A��һ��ͬ���칹����ŨH2SO4���ȣ�Ҳ����B��ˮ����ͬ���칹��Ľṹ��ʽΪ________��
(6)E�ж���ͬ���칹�壬�������������Ҿ���������λȡ������ͬ���칹�干��_____�֡�
���𰸡�![]() ��ȥ��Ӧ
��ȥ��Ӧ  +2Ag(NH3)2OH
+2Ag(NH3)2OH![]()
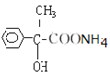 +2Ag+3NH3+H2O
+2Ag+3NH3+H2O 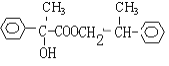
 4
4
��������
��֪B�����к��б������������ܶ���ͬ��ͬѹ��H2�ܶȵ�59������B����Է�������Ϊ118��1molB�����Ժ�4molH2�����ӳɷ�Ӧ��˵��B�к�һ��̼̼˫���������Ͷ�Ϊ5����B�ķ���ʽΪC9H10��B�ı����ϵ�һ����ԭ�ӱ�����ȡ�����õIJ��������֣�������ֻ��һ��ȡ������B����CΪ�ӳɷ�Ӧ��C����DΪ��ԭ�ӵ�ȡ����Ӧ��D���������ǻ���D����EΪ���Ĵ�������Ӧ��E����FΪ������Ӧ��F�����к����ǻ����Ȼ���˵��D����һ���ǻ����ܷ�����������E��G���ܹ�����������Ӧ��˵�������к���ȩ������D��һ���ǻ�����������ȩ������B�Ľṹ��ʽΪ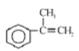 ��
��
(1) G���ܹ�����������Ӧ��˵�������к���ȩ����A����GΪ���Ĵ�������Ӧ��A����BΪ������ȥ��Ӧ��B�Ľṹ��ʽΪ ����֪A�Ľṹ��ʽ
����֪A�Ľṹ��ʽ![]() ��
��
(2) A�Ľṹ��ʽΪ![]() ��B�Ľṹ��ʽΪ
��B�Ľṹ��ʽΪ ����Ӧ�ٵķ�Ӧ��������ȥ��Ӧ��
����Ӧ�ٵķ�Ӧ��������ȥ��Ӧ��
(3) ���Ϸ�����E�Ľṹ��ʽΪ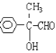 ����E��������Һ��Ӧ�Ļ�ѧ����ʽΪ
����E��������Һ��Ӧ�Ļ�ѧ����ʽΪ![]() +2Ag(NH3)2OH
+2Ag(NH3)2OH![]()
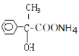 +2Ag+3NH3+H2O��
+2Ag+3NH3+H2O��
(4)A�Ľṹ��ʽΪ![]() ��F�Ľṹ��ʽΪ
��F�Ľṹ��ʽΪ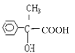 �������ʵ�����A��F����������Ӧ���������л���Ľṹ��ʽΪ
�������ʵ�����A��F����������Ӧ���������л���Ľṹ��ʽΪ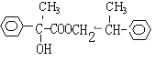 ��
��
(5)A��һ��ͬ���칹����ŨH2SO4���ȣ�Ҳ����B��ˮ����ͬ���칹��Ҳ�����ǻ��ܷ�����ȥ��Ӧ�����ͬ���칹��Ľṹ��ʽΪ![]() ��
��
(6) E�Ľṹ��ʽΪ ���������������Ҿ���������λȡ������������λȡ��������ΪHCOO-��-CH2CH3��CH3COO-��-CH3��-CH3��-CH2OOCH��-CH3��-COOCH3����4�֣�������������ͬ���칹����4�֡�
���������������Ҿ���������λȡ������������λȡ��������ΪHCOO-��-CH2CH3��CH3COO-��-CH3��-CH3��-CH2OOCH��-CH3��-COOCH3����4�֣�������������ͬ���칹����4�֡�


 Сѧ��10���ӿ������100��ϵ�д�
Сѧ��10���ӿ������100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CH4-CO2�������������Եõ��ϳ�����CO��H2����������������ļ��ž�����Ҫ���塣�ش��������⣺
��1��CH4-CO2��������ӦΪ��CH4(g)+ CO2(g)=2CO(g)+2H2(g) ��H=+247kJ/mol��
�����������CH4ƽ��ת���ʵ�������____
A�� ���µ�ѹ B�����¸�ѹ C�����¸�ѹ D�����µ�ѹ
��ij�¶��£������Ϊ2 L�������м���2 mol CH4��1 mol CO2�Լ���������������Ӧ���ﵽƽ��ʱCO2��ת������50%����ƽ�ⳣ��Ϊ_______mol2��L2��
��2����Ӧ�д������Ի����̼��Ӧ�����ͣ�ͬʱ���ڵ���̼��Ӧ��ʹ��̼�����١�����������±���
��̼��ӦCH4(g)= C(s)+2H2(g) | ��̼��ӦCO2(g)+ C(s)= 2CO(g) | ||
��H/(kJ��mol1) | 75 | 172 | |
���/(kJ��mol1) | ����X | 33 | 91 |
����Y | 43 | 72 | |
�����ϱ��жϣ�����X____Y��������������������������������_________________���ڷ�Ӧ��������ɡ�ѹǿ����Ӧʱ����ͬ������£�ij��������Ļ�̼�����¶ȵı仯��ϵ��ͼ��ʾ�������¶�ʱ�����й��ڻ�̼��Ӧ����̼��Ӧ��ƽ�ⳣ����K�������ʣ�v����������ȷ����________
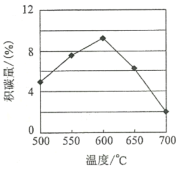
A��K����K��������
B��v������v������
C��K������K������
D��v�����ӵı�����v�����ӵı�����
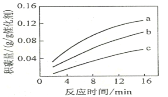
����һ���¶��£����ij�����ϳ���̼���������ʷ�v=k��p(CH4)��![]() ��kΪ���ʳ���������p(CH4)һ��ʱ����ͬp(CO2)�»�̼����ʱ��ı仯������ͼ��ʾ����pa(CO2)��pb(CO2)��pc(CO2)�Ӵ�С��˳��Ϊ________________��
��kΪ���ʳ���������p(CH4)һ��ʱ����ͬp(CO2)�»�̼����ʱ��ı仯������ͼ��ʾ����pa(CO2)��pb(CO2)��pc(CO2)�Ӵ�С��˳��Ϊ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼ�ϵ����Ŀǰ����о����ȵ�֮һ������ij����С�����Ƶ�����ȼ�ϵ�أ���ͼ��ʾ��a��b��Ϊ���Ե缫������������ȷ����
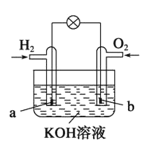
A.�ܷ�Ӧ����ʽΪ2H2+O2![]() 2H2O
2H2O
B.a����Ӧ��H2��2e����2H��
C.ʹ�ù����е������Һ��pH��С
D.b�缫���������õ缫�Ϸ���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˽�����Na2SO4��NaHCO3��NaCl�����ᴿ���Ƶô������Ȼ�����Һ��ijѧϰС�����������ͼ��ʾ��ʵ�鷽����
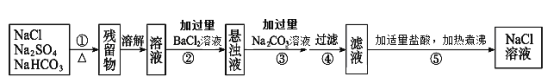
�ش��������⣺
��1�������ټ��ȹ����У�������Ӧ�Ļ�ѧ����ʽ��_______��
��2�������ڲ���Ba��NO3��2��Һ�������ǣ�__________��
��3�����в������У��ж���BaCl2��Һ�Ƿ�������ķ����ǣ�_________��
��4�����������������Na2CO3��Һ����Ŀ���ǣ�________��
��5����������������������������ҪĿ����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(NaN3)���Ʊ�ҽҩ��ըҩ��һ����Ҫԭ�ϣ����á��������������ˮ���·����Ʊ��������Ƶ������������£�
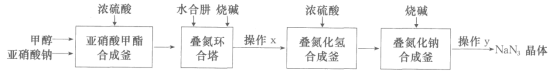
�ش��������⣺
��1������������ϳɸ������ɵ����������(CH3ONO)��ת��Ϊ��̬���������������д������CH3ONO�Ļ�ѧ��Ӧ����ʽ��___��
��2�����������������ɵ������Ƶķ�Ӧ����ʽΪ___��
��3��ˮ����(N2H4��H2O)����������һˮ�ϰ��������ᷴӦ����������ʽ�Σ����εĻ�ѧʽΪ___�������������еμӵ��ռ���ҺҪ�ʵ�������Ŀ����__ �����������в���xΪ���ȡ�Ũ������ʱ����Ũ��Һ�������к��ƵĻ�������Na2SO4��___��
��4�������������п�ѭ��ʹ�õ�������___��
��5����������HN3���ɣ������ʵ��֤��HN3Ϊ���___��
��6�����������У������NaN3��ʹ�ô���������Һ�����������������£����߷�Ӧ�������������塣������6.5gNaN3�������������0.5mol��L��1��NaClO��Һ___mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ��ɽ���ǽ�ɽ��ɽ��������������Ⱦ��ĺ��������Ի�������������Ҫ���塣
��1������ijЩ�������ɹ�ʵ�ֽ������е�̼��������͵���������ת��Ϊ���Ĵ���ѭ�����ʡ�
��֪���� 2NO��g��+O2��g��![]() 2NO2��g����H3����112.0kJmol��1
2NO2��g����H3����112.0kJmol��1
�� NO��g��+CO��g��![]()
![]() N2��g��+CO2��g����H2����379.9kJmol��1
N2��g��+CO2��g����H2����379.9kJmol��1
�� N2��g��+O2��g��![]() 2NO��g����H1��+179.8kJmol��1
2NO��g����H1��+179.8kJmol��1
��ӦNO��g��+CO2��g��![]() NO2��g��+CO��g������H��_____kJmol��1��ij�¶��£���Ӧ�٢ڢ۵�ƽ�ⳣ���քeΪK1��K2��K3����÷�Ӧ��K����____����K1��K2��K3��ʾ����
NO2��g��+CO��g������H��_____kJmol��1��ij�¶��£���Ӧ�٢ڢ۵�ƽ�ⳣ���քeΪK1��K2��K3����÷�Ӧ��K����____����K1��K2��K3��ʾ����
(2)һ���¶��£���ij�ܱ������г���1 mol NO2��������Ӧ��2NO2(g) ![]() N2O4(g)����÷�Ӧ��ϵ���������������ѹǿ֮��Ĺ�ϵ��ͼ��ʾ��
N2O4(g)����÷�Ӧ��ϵ���������������ѹǿ֮��Ĺ�ϵ��ͼ��ʾ��
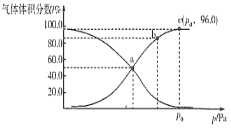
��a��b��c�����淴Ӧ�����ɴ�С��˳��Ϊ___________��ƽ��ʱ������ѹǿ���¶Ȳ��䣬������ϵ�м���һ������Ne����ƽ��___________�ƶ�(��������������������������)��
��a��ʱNO2��ת����Ϊ___________����ƽ���ѹ����ƽ��Ũ��Ҳ�����ƽ�ⳣ��Kp������¶���Kp=___________Pa��1��
(3) �����£��ֱ�ȡδ֪Ũ�ȵ�HA��MOH��Һ����ˮϡ����ԭ�������n����ϡ�����У�����Һ��pH�仯��ͼ��ʾ��
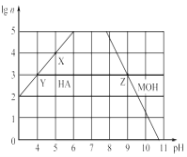
��HAΪ______�ᣬMOHΪ ________�����ǿ��������������
��X��Y��Z����ˮ�ĵ���̶ȹ�ϵ�ǣ�________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ��JohnB��Goodenough�ٻ�2019��ŵ������ѧ������ָ����̬��ϵ﮵����﮵��δ����չ����Kumar�����״��о��˹�̬�ɳ�硢��ȫ���������﮿�����أ���ṹ��ͼ��ʾ����֪��λ�����ĵ缫���Ϸų����ܵĴ�С��Ϊ��صı�����������˵��������ǣ� ��
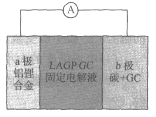
A.a����ӦΪ��Li��e-=Li+��b��������ԭ��Ӧ
B.���ʱ��Li����a��ͨ��������Һ��b���ƶ�
C.��·��ת��4mol���ӣ���Լ��Ҫ��״����112L����
D.��Ǧ������ȣ��õ�صı�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������
��1��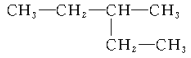 ___��
___��
��2��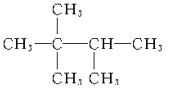 ___��
___��
��3��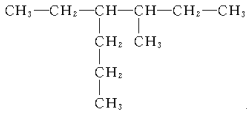 ___��
___��
��4��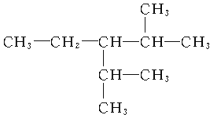 ___��
___��
��5��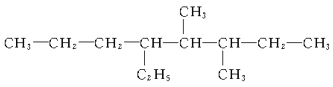 ___��
___��
��6��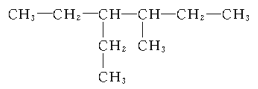 ___��
___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
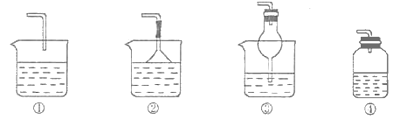
����Ŀ��ij��ѧʵ��С��ͬѧ����ͼ��ʾװ�ý���ϵ��ʵ�飬��̽�����������(������������ȥ)��
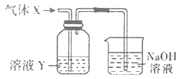
�ش��������⣺
��1��������XΪ��������ҺYΪ��������KSCN��FeCl2��Һ����ɹ۲쵽��ҺY�е�ʵ��������___��д��NaOH��Һ�з�����Ӧ�����ӷ���ʽ��___��
��2������ҺYΪƷ����Һ������Xͨ������Һ��ɫ��ȡ������ɫ�����Һ���Ⱥ�ָ�Ϊ��ɫ��������X������___(�ѧʽ)����������X�����ʣ�����ʵ��װ��Ӧ��һ���ĸĽ���������װ���п����������β������װ�õ���___(�����)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com