
某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:SO2+2NaOH = ________________.
(2)反应Cl2+Na2SO3+2 NaOH===2NaCl+Na2SO4+H2O中的还原剂为________________.
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl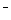 、OH
、OH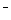 和SO
和SO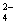 .请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
① 提出合理假设 .
假设1:只存在SO32-;假设2:既不存在SO32-也不存在ClO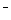 ;假设3:_____________.
;假设3:_____________.
② 设计实验方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:3moL L-1H2SO4、1moL
L-1H2SO4、1moL L-1NaOH、0.01mol
L-1NaOH、0.01mol L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3 moL | |
| 步骤2: | |
| 步骤3: |
【解析】(1) NaOH过量,故生成的是正盐:SO2+2NaOH =Na2SO3+H2O。
(2)S元素的价态从+4→+6,失去电子做表现还原性,故还原剂为Na2SO3。
(3)①很明显,假设3两种离子都存在。
②加入硫酸的试管,若存在SO32-、ClO-,分别生成了H2SO3和HClO;在A试管中滴加紫色石蕊试液,若先变红后退色,证明有ClO-,否则无;在B试管中滴加0.01mol L-1KMnO4溶液,若紫红色退去,证明有SO32-,否则无。
L-1KMnO4溶液,若紫红色退去,证明有SO32-,否则无。
【答案】
(1) Na2SO3+H2O
(2) Na2SO3
(3) ①SO32-、ClO-都存在
②
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3 moL | |
| 步骤2:在A试管中滴加紫色石蕊试液 | 若先变红后退色,证明有ClO-,否则无 |
| 步骤3:在B试管中滴加0.01mol | 若紫红色退去,证明有SO32-,否则无 |


科目:高中化学 来源: 题型:
已知:(1)Zn(s)+1/2O2(g)==ZnO(s),ΔH=-348.3kJ/mol
(2) 2Ag(s)+1/2 O2(g)== Ag2O(s),ΔH=-31.0kJ/mol
则Zn(s)+ Ag2O(s)== ZnO(s)+ 2Ag(s)的ΔH等于
A.-317.3kJ/mol B. -379.3kJ/mol
-379.3kJ/mol
C.-332.8 kJ/mol D.317.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列名选项均有X、Y两种物质,将X缓缓滴入(通入)Y溶液中,无论是否过量,均能用同一离子方程式表示的是
| A | B | C | D | |
| X | 稀盐酸 | 偏铝酸钠溶液 | 氨水 | 二氧化碳 |
| Y | 碳酸钠溶液 | 硫酸溶液 | 硝酸溶液 | 苯酚钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列鉴别方法可行的是
A.用氨水鉴别Al3+、Mg2+和Ag+
B.用Ba(NO3)2溶液鉴别Cl-、SO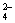 和CO
和CO
C.用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷
D.用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作与预期实验目的或所得实验结论一致的是
| 选项 | 实验操作 | 实验目的或结论 |
| A | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 说明该钾盐是 |
| B | 向含有少量 | 除去 |
| C | 常温下,向饱和 | 说明常温下
|
| D |
| 检验制得气体是否为乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。
完成下列填空:
1)用浓盐酸配制1:1(体积比)的稀盐酸(约6 mol.L-1),应选用的仪器是 。
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶
2)上述装置中,A是 溶液,NaHCO3溶液可以吸收 。
3)上述装置中,b物质是 。用这个实验得到的气体测定CO2的分子量,如果B物质失效,测定结果 (填“偏高”、“偏低”或“不受影响”)。
4)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:
剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重
为了将石蜡和碳酸钙溶出,应选用的试剂是 。
a.氯化钠溶液 b.稀醋酸 c.稀硫酸d 正已烷
5)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出 后溶出 。
6)上述测定实验中,连续 ,说明样品已经恒重。
查看答案和解析>>
科目:高中化学 来源: 题型:
某厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| pH | 3.2 | 5.2 | 12.4 |
部分阳离子以 氢氧化物形式完全沉淀时溶液的pH见上表,请回答下列问题:
氢氧化物形式完全沉淀时溶液的pH见上表,请回答下列问题:
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有________________________(要求写出两条)。
(2)滤渣Ⅰ的主要成分有____________________________。
(3)从滤液Ⅱ中可回收利用的主要物质有________________________。
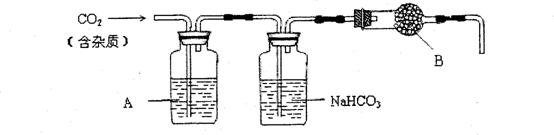
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3====Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因:________________________________________________________________________。
②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:______________________________。除去产品中该杂质的方法是:_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
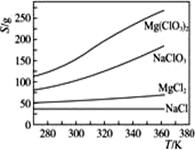
在室温和大气压强下,用图示的装置进行实验,测得ag含CaC290%的样品与水完全反应产生的气体体积bL。现欲在相同条件下,测定某电石试样中CaC2的质量分数,请回答下列问题:
(1)CaC2和水反应的化学方程式是___________________________。
(2)若反应刚结束时,观察到的实验现象如图所示,这时不能立即取出导气管,理由是___________________________。
(3)本实验中测量气体体积时应注意的事项有___________________________________。
(4)如果电石试样质量为cg,测得气体体积为dL,则电石试样中CaC2的质量分数计算式w(CaC2)=_______________________。(杂质所生成的气体 体积忽略不计)。
体积忽略不计)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com