
【题目】根据原子结构、元素周期表和元素周期律的知识回答下列问题:
(1)A元素次外层电子数是最外层电子数的![]() ,其外围电子的轨道表示式是 ________ 。
,其外围电子的轨道表示式是 ________ 。
(2)B是1~36号元素原子核外电子排布中未成对电子数最多的元素,B元素的名称是 _______ ,在元素周期表中的位置是 _______ 。
(3)C元素基态原子的轨道表示式是下图中的 ____________ (填序号),另一轨道表示式不能作为基态原子的轨道表示式是因为它不符合 ____________ (填序号)。
①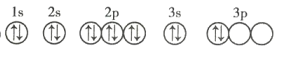
②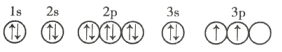
A 能量最低原则 B 泡利不相容原理 C 洪特规则
(4)元素的气态电中性基态原子失去最外层一个电子转化为气态基态正离子所需的最低能a叫作第一电离能(设为E)。第三周期元素的第一电离能示意图如图所示:
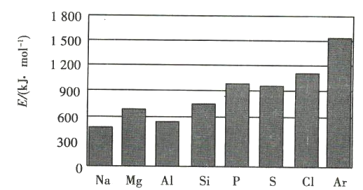
①同周期内,随着原子序数的增大,E值变化的总趋势是 ____________ ;
②根据图中提供的信息,可推断出E氧 ______ E氟(填“>”“<”或“=”,下同);
③根据第一电离能的含义和元素周期律,可推断出E镁 ____________ E钙。
【答案】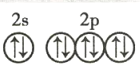 铬 第四周期第ⅥB族 ② C 增大 < >
铬 第四周期第ⅥB族 ② C 增大 < >
【解析】
(1)次外层电子数是最外层电子数的![]() 的元素是氖;
的元素是氖;
(2)1~36号元素中,原子核外电子排布中未成对电子数最多的元素是铬,共有6个未成对电子,在元素周期表中的位置是第四周期第ⅥB族;
(3)由该基态原子的轨道表示式中的电子数可知,C元素是硅,根据洪特规则,当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,且自旋方向相同,故硅元素基态原子的轨道表示式为②,另一轨道表示式不能作为基态原子的轨道表示式是因为它不符合洪特规则,故选C;
(4)①同周期内,随着原子序数的增大,第一电离能变化的总趋势是增大,E值变化的总趋势是增大;
②根据图中提供的信息,随着原子序数的增大,第一电离能变化的总趋势是增大,(处于半满、全满,能量较低),则E氧< E氟;
③同主族内,随着电子层数的增多,第一电离能变化的总趋势是减小,可推断出E镁>E钙。


科目:高中化学 来源: 题型:
【题目】如图是金属钨晶体中的一个晶胞的结构模型(原子间实际是相互接触的)。它是一种体心立方结构。实验测得金属钨的密度为19.30g·cm-3,钨的相对原子质量为183.9.假定金属钨为等直径的刚性球,请回答以下各题:
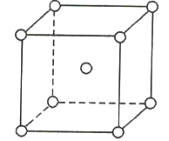
(1)每一个晶胞中分摊到__________个钨原子。
(2)计算晶胞的边长a。_____________
(3)计算钨的原子半径r(提示:只有体对角线上的各个球才是彼此接触的)。___________
(4)计算金属钨原子采取的体心立方密堆积的空间利用率。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知高锰酸钾与重铬酸钾(K2Cr2O7)都是化学中常用的强氧化剂,高锰酸钾溶液呈紫红色而重铬酸钾溶液中存在如下平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O,若要使溶液的橙色加深,下列可采用的方法是( )
Cr2O72-(橙色)+H2O,若要使溶液的橙色加深,下列可采用的方法是( )
A.加入适量小苏打B.加入适量稀硝酸
C.加入适量烧碱固体D.加水稀释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mol L-1的HC1溶液,测得溶液中某几种离子的物质的量的变化情况如图所示。下列说法不正确的是
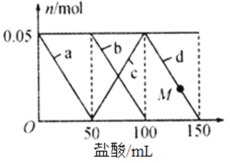
A.b和c曲线表示的离子反应均为CO32-+H+= HCO3-
B.结合H+的能力:AlO2>CO32> HCO3>Al(OH)3
C.原混合溶液中,CO32与AlO2的物质的量之比为2∶1
D.M点时A1(OH)3的质量等于3.9 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素X、Y、Z、W、Q的原子序数依次增大。X与Y同周期且相邻,Y的基态原子的s电子数与p电子数相等,Z是地壳中含量最多的金属元素,W的原子核外价电子排布式为![]() ,Q的基态原子的未成对电子数是同周期元素中最多的。下列说法错误的是( )
,Q的基态原子的未成对电子数是同周期元素中最多的。下列说法错误的是( )
A.简单气态氢化物的稳定性:Y>X
B.简单离子的半径:Z>X>Y
C.Z的最高价氧化物对应的水化物既能与强酸反应,又能与强碱反应
D.由Y、W、Q三种元素形成的某种化合物可用于检查司机是否酒后驾车
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、Q、E、M、G原子序数依次增大的七种元素,除G元素外其余均为短周期主族元素。X元素原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的价电子排布式为![]() ,Q元素基态原子核外成对电子数足未成对电子数的 3倍,E与Q位于同周期,M元素的第一电离能在 同周期主族元素中排第三位,G元素原子的价电子 排布式为
,Q元素基态原子核外成对电子数足未成对电子数的 3倍,E与Q位于同周期,M元素的第一电离能在 同周期主族元素中排第三位,G元素原子的价电子 排布式为![]() 。回答下列问题:
。回答下列问题:
(1)写出第3周期基态原子未成对电子数与G的相同且电负性最大的元素: ___________ (填元素名称)。GQ受热分解生成![]() 和
和![]() ,请从G的原子结构来说明
,请从G的原子结构来说明![]() 受热易分解的原因: ______ 。
受热易分解的原因: ______ 。
(2) Z、Q、M三种元素的第一电离能由大到小的顺序为 _________ (用元素符号表示)。
(3) Y与Q形成原子个数比为1:2的化合物的电子式为 _________ 。
(4) Z、M、E所形成的简单离子的半径由大到小的顺序为 __________ (用离子符号表示)。
(5) X、Y、Z、Q的电负性由大到小的顺序为 _______ (用元素符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A.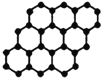 24g石墨烯中含有C-C键的个数为3NA
24g石墨烯中含有C-C键的个数为3NA
B.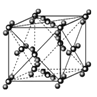 88g干冰中含有NA个晶胞结构单元
88g干冰中含有NA个晶胞结构单元
C.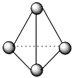 62gP4含有P-P键的个数为6NA
62gP4含有P-P键的个数为6NA
D.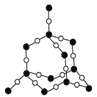 60gSiO2中含有Si-O键的个数为2NA
60gSiO2中含有Si-O键的个数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的石墨夹层离子化合物。将石墨置于熔融的钾或气态的钾中,石墨吸收钾而形成称为钾石墨的物质,其组成可以是C8K、C12K、C24K、C36K、C48K、C60K等等。在钾石墨中,钾原子把价电子交给石墨层,但在遇到与金属钾易反应的其他物质时还会收回。下列分析中正确的是( )

A. 题干中所举出的6种钾石墨,属于同素异形体
B. 若某钾石墨的原于分布如图一所示,则它所表示的是C24K
C. 若某钾石墨的原子分布如图二所示,则它所表示的是C12K
D. 另有一种灰色的钾石墨C32K,其中K的分布也类似图中的中心六边形,则最近两个K原子之间的距离为石墨键长的4![]() 倍
倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】β-氮化碳的硬度超过金刚石晶体,成为首屈一指的超硬新材料,已知该氮化碳的二维晶体结构如图所示。下列说法不正确的是( )
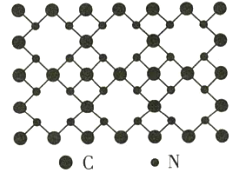
A.该晶体中的碳、氮原子都满足8电子稳定结构
B.该晶体中碳显+4价,氮显-3价
C.该晶体中每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连
D.该晶体的分子式为C3N4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com