
【题目】常用药﹣羟苯水杨胺,其合成路线如图。回答下列问题:
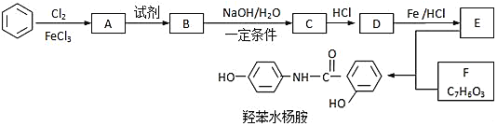
已知:![]()
(1)羟苯水杨胺的化学式为___。1mol羟苯水杨胺最多可以和___molNaOH反应。
(2)D中官能团的名称___。
(3)A→B反应所加的试剂是___。
(4)F存在多种同分异构体。
F的同分异构体中既能与FeCl3发生显色反应,又能发生银镜反应,且核磁共振氢谱显示4组峰,峰面积之比为1:2:2:1的同分异构体的结构简式___。
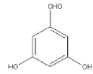
【答案】C13H11NO3 3 羟基、硝基 浓硝酸和浓硫酸 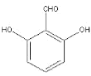 、
、 、
、
【解析】
苯与氯发生取代反应得到氯苯A,根据题目给出的信息可知D中含有硝基,这个硝基只能是A到B的过程中引入的,而产物中左边的苯环上的取代基是对位的,因此B为对硝基氯苯,碱性条件下水解得到对硝基苯酚钠C,加酸中和后得到对硝基苯酚D,还原后得到对氨基苯酚E,根据F的分子式和最终产物的结构不难推出F是邻羟基苯甲酸(水杨酸),E和F脱水形成肽键,得到最终产物,据此来分析题目即可。
(1)根据结构得出其化学式为C13H11NO3,首先2个酚羟基能消耗2个氢氧化钠,水解后形成的羧酸又能消耗1个氢氧化钠形成羧酸盐,因此1mol产物一共可以消耗3mol氢氧化钠;
(2)D为对硝基苯酚,其中含有的官能团为硝基和羟基;
(3)根据分析,A→B是硝化反应,需要的试剂为浓硝酸和浓硫酸;
(4)能和氯化铁发生显色反应证明有酚羟基,能发生银镜反应证明有醛基,然后还有4种等效氢,一共有3种符合条件的同分异构体,分别为 、
、 、
、 。
。


科目:高中化学 来源: 题型:
【题目】工业上电解 NaHSO4 溶液制备 Na2S2O8(其中阴离子结构为![]() )。其中阴极材料为 Pb;阳极材料为铂。下列说法不正确的是
)。其中阴极材料为 Pb;阳极材料为铂。下列说法不正确的是
A.SO42-向阳极迁移
B.阳极可换为铜电极
C.阳极反应中 S 的化合价不变
D.阴极电极反应式:2H++2e-=H2↑。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
①Al2O3![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3
Al(OH)3
②S![]() SO3
SO3![]() H2SO4
H2SO4
③饱和NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
④Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
⑤MgCl2(aq) ![]() Mg(OH)2
Mg(OH)2 ![]() MgO
MgO
A.①②③B.②③④C.①③⑤D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa下,稀强酸与稀强碱溶液反应中和热为57.3kJ/mol。
(1)写出表示稀H2SO4与稀烧碱溶液反应的中和热的热化学方程式:___。
(2)学生甲用50mL0.25mol/L硫酸与50mL0.55mol/L烧碱溶液测定中和热装置如图。
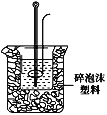
①实验时所需的玻璃仪器除烧杯、量筒外还需:__。
②该装置中有一处错误是:___。如果用该错误装置测定,测得的中和热ΔH会___(填“偏大、偏小、无影响”)。
③如果用60mL0.25mol/L硫酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热___(填“相等、不相等”)。
④若反应前溶液以及中和后的混合液的密度均设为1g/cm3,混合前酸与碱的温度均为t1,混合后溶液的温度为t2,比热容为4.18J/(g·℃),则中和热ΔH=___。
(3)学生乙用2mol/L的硫酸来测定与锌粒和锌粉反应的快慢,设计如图装置:
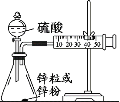
该生两次实验测定时间均设定为10min,则他还要测定的另一个数据是:___。
②若要减小产生H2的速率而又不影响产生H2的总量,应向硫酸中加入___(填字母)
a.Na2CO3溶液 b.K2SO4溶液 c.NaNO3溶液 d.水 e.CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个巨大的资源宝库,海水开发利用的部分过程如图所示。下列有关说法不正确的是( )
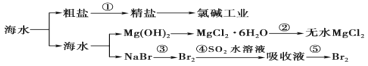
A.①粗盐制精盐除采用过滤泥沙外,还必须除去 Ca2+、Mg2+、SO42-等杂质
B.工业生产中常选用石灰乳作为 Mg2+的沉淀剂,并对沉淀进行洗涤
C.第②步的反应是将 MgCl26H2O 晶体在空气中直接加热脱去结晶水得无水 MgCl2
D.第③步到第⑤步空气吹出法提取海水中溴通常使用 SO2 作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】麻黄素M是拟交感神经药。合成M的一种路线如图所示:
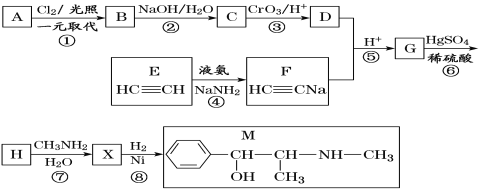
已知:I.R—CH2OH![]() RCHO
RCHO
II.R1-CHO+R-C≡CNa![]()
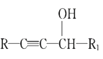
IV.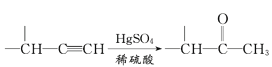
V.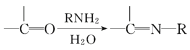
请回答下列问题:
(1)D的名称是_______;G中含氧官能团的名称是_______。
(2)反应②的反应类型为_______;A的结构简式为_______。
(3)写出反应⑦的化学方程式:______________________________。
(4)X分子中最多有_______个碳原子共平面。
(5)在H的同分异构体中,同时能发生水解反应和银镜反应的芳香族化合物中,核磁共振氢谱上有4组峰,且峰面积之比为1∶1∶2∶6的有机物的结构简式为_________________。
(6)已知:![]() 仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体
仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体![]() 的路线________________。
的路线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用如图装置(部分固定装置略去)制备氮化钙(Ca3N2),并探究其实验式。
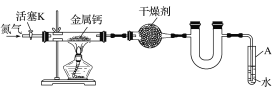
按图连接好实验装置。检查装置的气密性,方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为_____________________。
(2)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
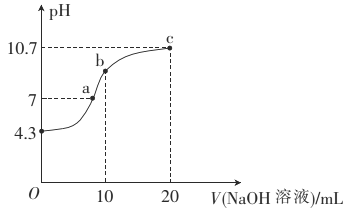
①写出H2N2O2在水溶液中的电离方程式:______________。
②b点时溶液中c(H2N2O2)_____(填“>”、“<”或 “=”,下同)c(N2O22-)。
③a点时溶液中c(Na+)____c(HN2O2-)+c(N2O22-)。
(3)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中![]() =______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
=______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
查看答案和解析>>
科目:高中化学 来源: 题型:
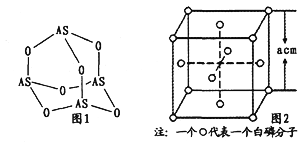
【题目】【化学-选修3:物质结构与性质】张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)N、P、As原子的第一电离能由大到小的顺序为_______;As原子的核外电子排布式为______________。
(2)NH3的沸点比PH3_____(填“高"或“低”),原因是_____________。
(3)Na3AsO4中含有的化学键类型包括_______;AsO43-的空间构型为_______,As4O6的分子结构如图1所示,则在该化合物中As的杂化方式是_________。
(4)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小圆圈表示白磷分子)。己知晶胞的边长为acm,阿伏加德罗常数为NAmol-1,则该晶胞中含有的P原子的个数为______,该晶体的密度为___g·cm-3(用含NA、a的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com