
| X | Y | |
| Z | W |
分析 由短周期元素X、Y、Z、W在元素周期表中的位置,可知X、Y处于第二周期,Z、W处于第三周期,Y原子的最外层电子数是其电子层数的3倍,最外层电子数为6,故Y为O元素,可推知X为N元素、Z为S元素、W为Cl,以此解答该题.
解答 解:(1)W为Cl元素,处于周期表中第三周期第VIIA 族,故答案为:第三周期第VIIA 族;
(2)核外电子排布相同的离子,核电荷数越大,离子半径越小,且离子核外电子层数越多,离子半径越大,则有离子半径O2-<N3-<Cl-<S2-,非金属性越强,气态氢化物的稳定性越强,由于非金属性:O>S,所以气态氢化物的稳定性:H2O>H2S,
故答案为:O2-<N3-<Cl-<S2-;H2O>H2S;
(3)在一定条件下,化合物Q与Y的单质反应达平衡时有三种气态物质,反应方程式为:2SO2+O2?2SO3,反应时,每转移4mol电子放热190.0kJ,则参加反应二氧化硫为$\frac{4mol}{2}$=2mol,该反应的热化学方程式是:2SO2 (g)+O2(g)?2SO3(g)△H=-190.0 kJ•mol-1,
故答案为:2SO2(g)+O2(g)?2SO3(g)△H=-190.0 kJ•mol-1;
(4)化合物S2Cl2可与水反应生成一种能使品红溶液褪色的气体,该气体为SO2,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,故S元素化合价降低,转移0.3mol电子生成二氧化硫为0.1mol,故有0.3molS原子发生还原反应,根据电子转移守恒可知S元素在还原产物中的化合价为0,故生成S,同时生成HCl,该反应的化学方程式为:2S2Cl2+2H2O═3S↓+SO2↑+4HCl,
故答案为:2S2Cl2+2H2O=SO2+3S+4HCl.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语的考查,较好的考查学生运用知识分析问题、解决问题的能力,难度中等.


科目:高中化学 来源: 题型:实验题
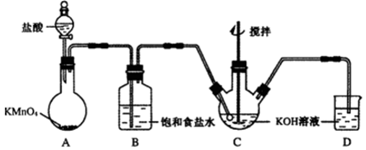
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液使蓝色石蕊试纸变红:Fe3++3H2O═3H++Fe(OH)3 | |
| B. | FeCl3溶液中滴加氨水出现红褐色沉淀:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Cu2++Fe2+ | |
| D. | 检验溶液中的Fe3+用KSCN溶液:Fe3++3SCN-?Fe(SCN)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
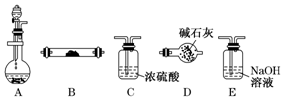 如图是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去).请根据下列要求回答问题.
如图是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去).请根据下列要求回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | T | X | Y | Z |
| 性质结构信息 | 原子核外s电子总数等于p电子总数;人体内含量最多的元素,且其单质是常见的助燃剂 | 单质为双原子分子,分子中含有3对共用电子对,常温下单质性质稳定,但其原子较活泼 | 第3周期元素的简单离子中半径最小 | 第4周期元素,M电子层为全充满状态,最外层只有一个电子的原子 |
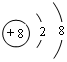 ;写出元素X的气态氢化物的电子式
;写出元素X的气态氢化物的电子式 ;X形成的单质分子,含1个σ键,2个π键.写出Z元素原子的外围电子排布式3d104s1;元素Y的原子核外共有2种形状不同的电子云.
;X形成的单质分子,含1个σ键,2个π键.写出Z元素原子的外围电子排布式3d104s1;元素Y的原子核外共有2种形状不同的电子云.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
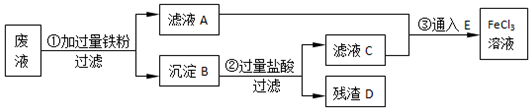
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上10月月考化学试卷(解析版) 题型:填空题
(1)已知16克A和20克B恰好完全反应生成0.05mol C和30克D,则C的摩尔质量为_________(2)0.3mol氨气和0.4mol二氧化碳的质量___________(填“相等”或“不相等”,下 同),
同),
所含原子数____________。
(3)4 g H2与22.4 L(标准状况)CO2相比,所含分子数目较多的是____________。
(4)3.01×1023个CO2分子中含 mol氧原子,在标准状况下其体积为 L,它与 g H2O含有相同的氧原子数。
(5)写出下列物质的电离方程式:硫酸铵__________ ____;氢氧化钡_______ ___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com