【答案】
分析:(1)根据氧化还原反应得失电子守恒配平反应方程式;
(2)实验有两个过程:①为了配制准确浓度的草酸溶液,所需要的实验仪器主要有天平(含砝码)、烧杯、药匙、100mL容量瓶、胶头滴管、玻璃棒等;
②用高锰酸钾溶液进行滴定测草酸的物质的量,所需要的实验仪器主要有烧杯、酸式滴定管、铁架台(带滴定管夹)、锥形瓶等;
(3)KMnO
4溶液具有强氧化性,可以腐蚀橡皮管,故KMnO
4溶液应装在酸式滴定管中;滴定时,左手控制滴定管活塞,右手摇动锥形瓶,眼睛注视溶液颜色的变化;KMnO
4溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO
4溶液,紫色不褪去,说明滴定到终点,不需要外加指示剂;
(4)根据化学方程式中各物质的关系进行计算;
(5)两者正好1:1反应生成NaHC
2O
4,溶液显酸性说明HC
2O
4-的电离程度大于其水解程度,可得离子浓度间的大小关系;
解答:解:(1)反应中根据氧化剂得失电子守恒可知氧化剂和还原剂物质的量之间的关系为:2MnO
4-~5H
2C
2O
4,在根据电荷守恒和质量守恒可写出反应方程式为:2KMnO
4+5 H
2C
2O
4+3H
2SO
4═K
2SO
4+10CO
2↑+2 MnSO
4+8H
2O,故答案为:2KMnO
4+5 H
2C
2O
4+3H
2SO
4═K
2SO
4+10CO
2↑+2 MnSO
4+8H
2O;
(2))①为了配制准确浓度的草酸溶液,所需要的实验仪器主要有天平(含砝码)、烧杯、药匙、100mL容量瓶、胶头滴管、玻璃棒等;②用高锰酸钾溶液进行滴定测草酸的物质的量,所需要的实验仪器主要有烧杯、酸式滴定管、铁架台(带滴定管夹)、锥形瓶等,故答案为:c,f;
(3)KMnO
4溶液具有强氧化性,可以腐蚀橡皮管,故KMnO
4溶液应装在酸式滴定管中;滴定时,左手控制滴定管活塞,右手摇动锥形瓶,眼睛注视溶液颜色的变化;KMnO
4溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO
4溶液,紫色不褪去,说明滴定到终点,不需要外加指示剂,故答案为:酸;酸溶液由无色变为浅紫色且半分钟不褪色;
(4)2KMnO
4 ~5H
2C
2O
4
2mol 5mol
aV×10
-3mol 0.025×Cmol
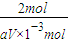
=
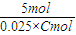
解得:C=0.1aVmol?L
-1H
2C
2O
4?xH
2O~H
2C
2O
4 ~xH
2O
1mol 18xg
0.1aV×0.1 w-0.1aV×0.1×90
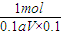
=
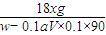
解得X=
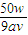
-5
故答案为:0.1aV;
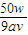
-5;
(5)两者正好1:1反应生成NaHC
2O
4,溶液显酸性说明HC
2O
4-的电离程度大于其水解程度,而溶液中还存在着水的电离,故H
+>C
2O
42-,由于离子的电离程度较小,则有HC
2O
4->H
+,故正确顺序为Na
+>HC
2O
4->H
+>C
2O
42->OH
-,故答案为:C(Na
+)>c(HC
2O
4-)>c(H
+)>c(C
2O
42-)>c(OH
-);
点评:本题考查一定物质的量浓度溶液配制、滴定操作、滴定应用与计算、物质组成含量测定等,难度中等,注意滴定中经常根据关系式进行计算,掌握根据关系式计算方法.

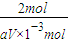 =
=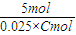
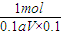 =
=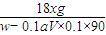
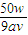 -5
-5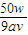 -5;
-5;

 春雨教育同步作文系列答案
春雨教育同步作文系列答案
 (2009?重庆)两个学习小组用图装置探究乙二酸(HOOC-COOH)受热分解的部分产物.
(2009?重庆)两个学习小组用图装置探究乙二酸(HOOC-COOH)受热分解的部分产物.