
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。且含B元素物质的大量燃烧是形成酸雨的主要原因之一。

(1)写出A、B、C三种元素的名称___、_____、___。
(2)A元素位于元素周期表中第___周期,第___族。
(3)B的原子结构示意图为___,用电子式表示元素B的钠盐的形成过程:___。
(4)由元素A、C及氢元素形成的化合物中含有的化学键的类型有___。
(5)A和C氢化物哪个更稳定:________(写出该氢化物的化学式)
【答案】 氮 硫 氟 二 V A 
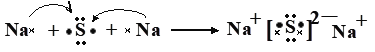 离子键、极性共价键 HF
离子键、极性共价键 HF
【解析】由A、B、C为短周期元素,结合在周期表中所处的位置可知,A、C为第二周期元素,设A的质子数为x,C的质子数为x+2,B的质子数为x+9,A、C两元素的原子核外电子数之和等于B原子的质子数,则x+x+2=x+9,解得x=7,即A为N,C为F,B原子核内质子数和中子数相等,B为S,S燃烧生成二氧化硫可导致酸雨发生;
(1)由上述分析可知,A、B、C的名称分别为氮、硫、氟;
(2)A为N,位于元素周期表中第二周期第VA族;
(3)B为S,质子数为16,其原子结构示意图为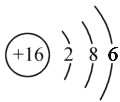 ,用电子式表示元素B的钠盐的形成过程为
,用电子式表示元素B的钠盐的形成过程为![]() ;
;
(4)由元素A、C及氢元素形成的化合物为NH4F,含有的化学键的类型有离子键、极性共价键;
(5)非金属性越强,对应氢化物越稳定,非金属性F>N,则A和C氢化物中HF更稳定。


科目:高中化学 来源: 题型:
【题目】在某澄清溶液中,可能存在下列几种离子:H+、K+、Ba2+、SO42-、I-、CO32-。取该溶液进行下列实验:
①用pH试纸检验,该溶液呈强酸性;
②取20mL溶液加入少量氯水和少量CCl4振荡后静置,CCl4层呈紫色;
③另取部分溶液逐滴加入NaOH溶液当溶液是碱性时,再加入Na2CO3溶液,有白色沉淀生成。
(1)根据上述实验现象、推断原溶液中肯定在的离子是________,肯定不存在的离子是_____,可能存在的离子是________。
(2)若步骤②中消耗0.01molCl2,则溶液中与Cl2反应的离子的物质的量浓度为_________。
(3)写出实验③中生成白色沉淀的离子方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废电池必须集中处理的首要原因是()
A. 不使电池渗泄的电解液腐蚀其他物品
B. 回收其中的石墨电极
C. 防止电池中汞、镉、铬、铅等重金属元素形成的有毒化合物对土壤和水源的污染
D. 回收其中的各种金属及塑料包装等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:

FeCl3溶液 /含有淀粉的碘水/NaOH溶液
A B C
(1)SO2气体还原Fe3+的氧化产物是____________(填离子符号),参加该反应的SO2和Fe3+的物质的量之比是____________。
(2)下列实验方案适用于在实验室制取所需SO2的是____________(填序号)。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是_______________________________________。
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有____________(填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(5)在上述装置中通入SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第二份试液加入铁氰化钾溶液,产生蓝色沉淀。
方案②:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是________,原因是__________________________________。
(6)能表明I-的还原性弱于SO2的化学方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为Kw,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A. 混合溶液的pH=7
B. 混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
C. a=b
D. 混合溶液中,c(H+)=![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沼气是一种能源,它的主要成分是CH4,0.5molCH4完全燃烧生成CO2和液态水时放出445kJ的热量,则下列热化学方程式中正确的是
A. 2CH4(g)+4O2(g)=2CO2(g)+4H2O(g)△H=+890kJmol﹣1
B. CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890kJmol﹣1
C. 1/2 CH4(g)+O2(g)=CO2(g)+H2O(l)△H=﹣890kJmol﹣1
D. CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2MgOB2O3H2O、SiO2及少量Fe3O4、CaCO3、Al2O3)为原料生产硼酸的工艺流程如图:

已知:i.Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4.
ⅱ.H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0g、8.7g、14.8g、40.2g.
(1)为了提高硼镁矿粉的浸出率,可采取的措施有___________(至少答两条).
(2)“浸出液”显酸性,含H3BO3和Mg2+、SO42﹣,还含有Fe3+、Fe2+、Ca2+、Al3+等杂质.“除杂”时向浸出液中依次加入适量H2O2和MgO,H2O2的作用是_______________________ (用离子方程式表示),MgO除去的杂质离子是____________________.
(3)已知H3BO3与过量的NaOH反应生成Na[B(OH)4],试写出H3BO3在溶液中的电离方程式_______________________.
(4)“浸取”后,采用“热过滤”的目的是______________,母液中的主要溶质有___________、___________(主要由两种).
(5)测定所得产品的纯度:取a g硼酸,小心加热使其分解脱去水分(杂质受热不分解),得残留固体b g,则产品的纯度为__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于碳原子(基态)核外电子运动状态的说法不正确的是( )
A.分布于2个电子层B.占有3个能级
C.占有3个原子轨道D.有4个电子自旋状态相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com