
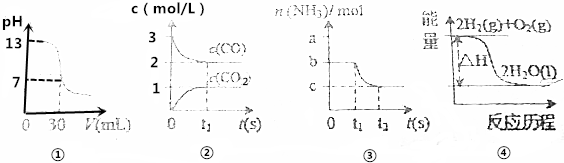
| A. | 图①表示25℃时,0.1000mol•L-1某一元酸滴定25.00mL 0.1000mol•L-1NaOH溶液,则根据图中数据可以计算出该温度下该一元酸的电离常数Ka | |
| B. | 图②表示某温度下的反应2CO(g)?C(s)+CO2(g)中的气体浓度随时间变化的曲线,则根据图中数据可计算该温度下的平衡常数K | |
| C. | 图③表示N2(g)+3H2(g)?2NH3(g)的平衡移动曲线,t1时刻改变的条件可能是降低压强 | |
| D. | 图④表示的反应热△H,可根据H2、O2、H2O的共价键的键能计算 |
分析 A.pH=7时,c(A-)+c(OH-)=c(H+)+c(Na+),c(OH-)=c(H+)=10-7mol/L,c(A-)=c(Na+)=$\frac{0.1×0.025}{0.025+0.03}$=0.04545mol/L,c(HA)=$\frac{0.1×0.03}{0.025+0.03}$-0.04545=0.01mol/L,根据Ka=$\frac{c({A}^{-})×c({H}^{+})}{c(HA)}$计算;
B.根据k=$\frac{c(C{O}_{2})}{{c}^{2}(CO)}$计算;
C.减小压强,平衡向逆方向移动;
D.根据H2、O2、H2O的共价键的键能计算出生成H2O(g)时的△H.
解答 解:A.pH=7时,c(A-)+c(OH-)=c(H+)+c(Na+),c(OH-)=c(H+)=10-7mol/L,c(A-)=c(Na+)=$\frac{0.1×0.025}{0.025+0.03}$=0.04545mol/L,c(HA)=$\frac{0.1×0.03}{0.025+0.03}$-0.04545=0.01mol/L,Ka=$\frac{c({A}^{-})×c({H}^{+})}{c(HA)}$=$\frac{0.04545×1{0}^{-7}}{0.01}$=4.545×10-7,故A正确;
B.由图可知,平衡时c(CO2)=1mol/L,c(CO)=2mol/L,则k=$\frac{c(C{O}_{2})}{{c}^{2}(CO)}$=$\frac{1}{{2}^{2}}$=$\frac{1}{4}$,故B正确;
C.N2(g)+3H2(g)?2NH3(g)达到平衡,减小压强,平衡向逆方向移动,所以n(NH3)减小,图象符合,故C正确;
D.△H=反应物的总键能-生成物的总键能,则用H2、O2、H2O的共价键的键能计算出生成H2O(g)时的△H,而图中生成的水为液态水,所以无法计算,故D错误.
故选D.
点评 本题考查了弱电解质的电离常数的计算、化学平衡常数的计算、化学平衡移动、反应热的计算等,题目难度中等,侧重于考查学生的分析能力和计算能力,注意D选项键能计算反应热时各物质的状态为气态.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式:CH2CH2 | B. | 甲烷分子的球棍模型: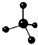 | ||
| C. | 乙醇的分子式:C2H5OH | D. | 氟离子的结构示意图: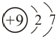 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第1A族均为碱金属元素 | |
| B. | 最外层有两个电子的原子一定在第ⅡA族 | |
| C. | 元素的最高化合价等于其原子的最外层电子数 | |
| D. | 第ⅦA族元素的阴离子还原性越强,其气态氢化物的稳定性越弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向HA溶液中逐滴加入少量NH3•H2O,$\frac{c({H}^{+})}{c({A}^{-})}$逐渐增大 | |
| B. | 常温下,0.1mol•L-1 HA溶液中水电离的c(H+)为10-13mol•L-1 | |
| C. | NaA溶液中加入HCl溶液至恰好完全反应,存在关系:2c(Na+)=c(A-)+c(Cl-) | |
| D. | 常温下,0.1mol•L-1 NaA溶液水解常数为10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X、Y、Z中Z的单质最稳定 | B. | Y的氢化物为H2Y | ||
| C. | H2Z能发生反应:Cl2+H2Z=Z+2HCl | D. | Y有含氧酸为HYO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
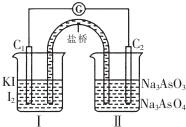 已知可逆反应AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如图装置,进行下述操作:
已知可逆反应AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如图装置,进行下述操作:| A. | ①操作过程中C1棒上发生的反应为2I--2e-═I2 | |
| B. | ②操作过程中盐桥中的阳离子移向(Ⅰ)烧杯 | |
| C. | 若将微安表换成惰性电极电解饱和食盐水的装置,在①操作过程中与C1棒连接的电极上有Cl2产生 | |
| D. | 若将微安表换成电解精炼铜装置,在②操作过程中与C2棒连接的为纯铜电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com