
【题目】以惰性电极电解少量硫酸铜溶液,一段时间后取出电极,加入19.6克氧化铜固体,固体完全溶解所得溶液与电解前相同(浓度、密度、体积等),则电解过程中电路中流过的电子为( )
A.0.2molB.0.4molC.0.6molD.0.8mol
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】学习小组设计如图所示装置,进行NO和![]() 假设二者物质的量之比为
假设二者物质的量之比为![]() 的处理并制取硝酸。下列说法正确的是
的处理并制取硝酸。下列说法正确的是![]()

A.ab适宜选用阴离子交换膜
B.该电池工作时,正极区溶液的pH减小
C.导线中流过![]() 电子的电量时,有
电子的电量时,有![]() 离子通过交换膜
离子通过交换膜
D.负极的电极反应式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置中,甲池的总反应式为2CH3OH+ 3O2+ 4KOH=2K2CO3+ 6H2O。试回答:
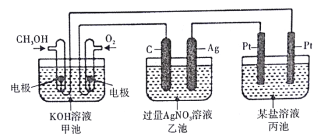
(1)图中甲池的装置是_________(填“原电池”或“电解池”),乙池中石墨电极是________极。
(2)写出通入CH3OH的电极的电极反应式:________________
(3)乙池中总反应的化学方程式为___________________
(4)当乙池中Ag极的质量增加5.40g时,甲池中理论上消耗O2________mL(标准状况);此时丙池某电极上析出1.60g某金属,则丙池中的盐溶液可能是________(填字母)
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意,完成下列问题。
(1)常温下,将1 mL pH=1的H2SO4溶液加水稀释到100 mL,稀释后的溶液pH=_____。
(2)某温度时,测得0.01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数Kw=______。该温度__________25℃(填“高于”、“低于”或“等于”)。
(3)常温下,设pH=5的H2SO4的溶液中由水电离出的H+浓度为c1;pH=9的Ba(OH)2溶液中由水电离出的H+浓度为c2,则c1/ c2=__________。
(4)常温下,pH=13的Ba(OH)2溶液aL与pH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计)。
若所得混合溶液呈中性,则a∶b=__________。若所得混合溶液pH=12,则a∶b=__________。
(5)向明矾溶液中逐渐加入Ba(OH)2溶液至硫酸根离子刚好沉淀完全时,溶液的pH______7(填>,<,=),离子反应总方程式为______________________。
(6)用实验确定某酸HA是弱电解质。两同学的方案是:
甲:a.称取一定质量的HA配制成0.1molL-1的溶液100mL;
b.用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:a.用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各 100mL;
b.分别取这两种溶液各10mL,加水稀释为100mL;
c.各取相同体积的两种稀释液装入两个试管中,同时加入纯度相同的锌粒,观察反应现象,即可证明HA是弱电解质。
①在两个方案的第①步中,都要用到的定量仪器是_______。
②甲方案中,说明HA是弱电解质的理由是测得溶液的pH____1(选填“>”、“<”或“=”)。
乙方案中,说明HA是弱电解质的现象是_______(多选扣分)。
A.装HCl溶液的试管中放出H2的速率快
B.装HA溶液的试管中放出H2的速率快
C.两个试管中生成气体的速率一样快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业产生的废气COx、NOx、SOx对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
(1)已知甲烷的燃烧热为890 kJ/mol;1 mol水蒸气变成液态水放热44 kJ;N2与O2反应生成NO的过程如下:
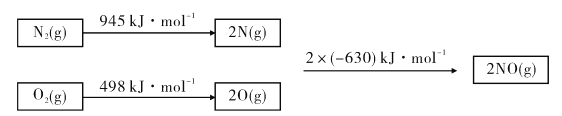
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=_______.
(2)汽车尾气中含有CO和NO,某研究小组利用反应:2CO(g)+2NO(g) ![]() N2 (g)+2CO2 (g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO和NO,能自发进行上述反应,测得不同时间的NO和CO的浓度如下表:
N2 (g)+2CO2 (g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO和NO,能自发进行上述反应,测得不同时间的NO和CO的浓度如下表:
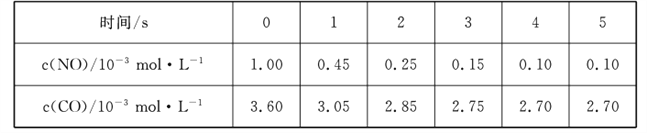
①0~2 s内用N2表示的化学反应速率为____,该温度下,反应的平衡常数K1_____。
②若该反应在绝热恒容条件下进行,则反应达到平衡后体系的温度为T2℃,此时的化学平衡常数为K2,则K1____K2(填“>”、“<”或“=”),原因是________
(3)向甲、乙两个容积均为1 L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2 mol SO2、1 mol O2,乙充入1 mol SO2、0.5 mol O2),发生反应:2SO2(g)+O2 (g) ![]() 2SO3 (g) △H= -197. 74 kJ/mol ,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如右图所示。下列说法正确的是______
2SO3 (g) △H= -197. 74 kJ/mol ,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如右图所示。下列说法正确的是______
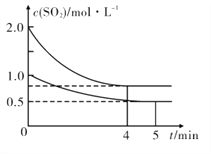
A.放出的热量Q:Q(甲)>2Q(乙)
B.体系总压强p:p(甲)>2p(乙)
C.甲容器达到化学平衡时,其化学平衡常数为4
D.保持其他条件不变,若起始时向乙中充入0.4 mol SO2、0.2mol O2、0.4 molSO3,则此时v(正>v(逆)
(4)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如右图所示。
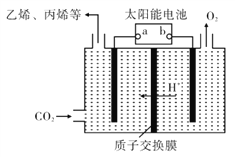
①该工艺中能量转化方式主要有____。
②电解时,生成乙烯的电极反应式是____。
(5)CO2在自然界循环时可与CaC03反应,Ca-CO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2 CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2 CO3溶液混合,若Na2 C03溶液的浓度为2×10-4 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示:
实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
1 | 25.00 | 24.41 |
2 | 25.00 | 24.39 |
3 | 25.00 | 24.60 |
回答下列问题:
(1)如图中甲为_________滴定管,乙为_______ 滴定管(填“酸式”或“碱式”)

(2)实验中,不需要润洗的仪器是:________________________
(3)取待测液NaOH溶液25.00ml 于锥形瓶中,使用酚酞做指示剂。滴定终点的判断依据是________
(4)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果____________(填“偏高”“偏低”“不变”,下同);若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果___________。
(5) 未知浓度的NaOH溶液的物质的量浓度为_____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,分别向20.00mL 0.10mol·L-1的氨水、醋酸铵溶液中滴加0.10mol·L-1的氢碘酸,溶液pH与加入氢碘酸体积的变化关系如图所示。下列说法正确的是
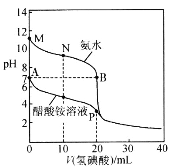
A.A点与B点由水电离产生的氢氧根浓度A点大于B点
B.M点,c(NH3·H2O)>c(OH-)>c(H+)>c(NH4+)
C.N点,c(I-)=c(NH3·H2O)+c(NH4+)
D.P点,c(H+)+c(CH3COOH)=c(OH-)+c(I-)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池构造如图所示,下列叙述正确的是( )

A. 在外电路中,电子由银电极流向铜电极
B. 取出盐桥后,电流表的指针仍发生偏转
C. 外电路中每通过0.1 mol电子,铜的质量理论上减小6.4 g
D. 原电池的总反应式为Cu+2AgNO3===2Ag+Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.pH=l的溶液中:Ba2+、Fe3+、Cl-、SCN-
B.能使酚酞变红的溶液:Ca2+、K+、HCO3-、CO32-
C.![]() =10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
=10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
D.由水电离的c(H+)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com