
����Ŀ��25��ʱ���ֱ���20��00mL 0.10mol��L-1�İ�ˮ���������Һ�еμ�0.10mol��L-1������ᣬ��ҺpH��������������ı仯��ϵ��ͼ��ʾ������˵����ȷ����
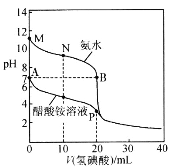
A.A����B����ˮ���������������Ũ��A�����B��
B.M�㣬c(NH3��H2O)>c(OH-)>c(H+)>c(NH4+)
C.N�㣬c(I-)=c(NH3��H2O)+c(NH4+)
D.P�㣬c(H+)+c(CH3COOH)=c(OH-)+c(I-)+c(NH3��H2O)
���𰸡�AD
��������
A��A��Ϊ�������Һ�������Ϊ���������Σ��ٽ�ˮ�ĵ��룬B��Ϊ�⻯��백ˮ�Ļ��Һ�������ƣ�Ҳ���ٽ�ˮ�ĵ��룬��ˮ���������������Ũ��A�����B�㣬A˵����ȷ��
B��M��Ϊ��ˮ����Һ�Լ��ԣ�c(NH3��H2O)>c(OH-)>c(NH4+)>c(H+)��B˵������
C��N��Ϊ�⻯��백ˮ�Ļ��Һ�������ʵ�����ȣ����������غ㣬2c(I-)=c(NH3��H2O)+c(NH4+)��C˵������
D��P��Ϊ�⻯������Ļ��Һ�������ʵ�����ȣ����ݵ���غ㣬c(NH4+)+c(H+)= c(OH-)+c(I-)+ c(CH3COO-)�����������غ㣬c(NH3��H2O)+c(NH4+)=c(I-)=c(CH3COOH)+c(CH3COO-)������c(NH4+)=c(I-)-c(NH3��H2O)��c(CH3COO-)=c(CH3COOH)- c(I-)�������غ�ĵ�ʽ�����ɵõ�c(H+)+c(CH3COOH)=c(OH-)+c(I-)+c(NH3��H2O)��D˵����ȷ��
��ΪAD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���о��к���ɫ����������Աȷ������ý��۲���ȷ���ǣ� ��
|
|
|
�� | �� | �� |
A.�ɢ��еĺ���ɫ���壬�ƶϲ���������һ���ǻ������
B.����ɫ���岻�ܱ�������ľ̿��Ũ���ᷢ���˷�Ӧ
C.�ɢ�˵��Ũ������лӷ��ԣ����ɵĺ���ɫ����Ϊ��ԭ����
D.�۵���������м���CO2���ɴ�˵��ľ̿һ����Ũ���ᷢ���˷�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������������Ʒ��������̨������Ȧ����ʽ���У� ����ƿ ����ʽ�ζ��ܺͼ�ʽ�ζ��� ���ձ� �ݲ����� ��ͷ�ι� ����ƽ�������룩 ����ֽ ����Ͳ �����©����
��������ҩƷ����A��NaOH���� ��B����NaOH��Һ��C��δ֪Ũ������ ��D������ˮ��E��̼������Һ
������������ѧ��ʵ�飬�ش��������⣺
��1������ʱ��Ӧѡ�õ�����������_________________________�����ţ���
��2������һ�����ʵ���Ũ�ȵ�NaOH��Һʱ����ȱ�ٵ�������__________��
��3��������к͵ζ�ʱ����ȱ�����Լ���____________________��
��4�������к͵ζ�ʱ���������ý�Ҫʢ����Һ������ϴ�����������е�______�����ţ����ף���ʽ�ζ��� �ң���ʽ�ζ��� ������ƿ
��5���ñ���NaOH��Һ�ζ�δ֪Ũ�ȵ����ᣬѡ�÷�̪��Ϊָʾ������ɲⶨ���ƫ�ߵ�ԭ�������______________��
A�����Ʊ���Һ��NaOH�л���Na2CO3����
B���ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�����������ȷ
C��ʢװδ֪Һ����ƿ������ˮϴ����δ��δ֪Һ��ϴ
D���ζ�ǰ�����ݣ��ζ���������ʧ��
II. �״���CH3OH����һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��ӦI��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H1
CH3OH(g)+H2O(g) ��H1
��ӦII��CO(g)+2H2(g)![]() CH3OH(g) ��H2
CH3OH(g) ��H2
�ٷ�ӦI��ƽ�ⳣ������ʽΪK=________________________
���±����������Ƿ�Ӧ���ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ��(K)
�¶� | 250�� | 300�� | 350�� |
K | 2.041 | 0.270 | 0.012 |
�ɱ��������ж���H2______0����S______0 (��������������������������)��
��ij�¶��£���2 mol CO��6 mol H2����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c(CO)=0.2 mol��L-1����CO��ת����Ϊ________��
��2����֪�ڳ��³�ѹ�£�ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ�����������ͼ��ʾ�ĵ��װ�ã�

��2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ��H ��-1275.6 kJ��mol-1
��H2O(g)��H2O(l) ��H ��-44.0 kJ��mol-1
��д����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽ____________________��
��д����ͼ���װ���и�����Ӧʽ��________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Զ��Ե缫�����������ͭ��Һ��һ��ʱ���ȡ���缫������19.6������ͭ���壬������ȫ�ܽ�������Һ����ǰ��ͬ(Ũ�ȡ��ܶȡ������)����������е�·�������ĵ���Ϊ( )
A.0.2molB.0.4molC.0.6molD.0.8mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ά����C�ķ���ʽ��C6H8O6��ˮ��Һ�����ԣ����»�ϳ�ʱ����������ģ���������ˮ�����߲ˡ�����Ʒ�ж����зḻ��ά����C�����磺���ʳ�֭�к�ά����CŨ����500mg��L��1���ҡ�ijУ��ѧ����С����вⶨ��֭��ά����C����ʵ�飬���������ǵ�ʵ����̼��������棬����ݴ˱�����д�йؿհס�
��ʵ��Ŀ�ģ��ⶨ����������װ�ʳ�֭ά����C������
��ʵ��ԭ����C6H8O6+I2��C6H6O6+2H++2I����
��ʵ����Ʒ���Լ���
����������Ʒ(��ѡ����)
���Լ���Ũ��Ϊ7.50��10��3mol��L��1�ı���(ˮ)��Һ��ָʾ��������ˮ�ȡ�
��ʵ����̣�
(1)ϴ������������Ƿ�©Һ���ñ�Һ��ϴ��װ�ñ�Һ���á��ڴ˲������У����ñ�Һ��ϴ��������_____________��
(2)��֭����Ŀ�⣺��ɫ-�Ȼ�ɫ�������-�ã�������____________ʢװ�ó�֭��ϴ2��3�飬��ȡ20.00mL��֭����ƿ����ƿ�м���2��ָʾ������ָʾ����������____________��
(3)�����ֲ����ζ��ܣ�����ҡ����ƿ���۾�ע��___________���ζ����յ�ʱ��������__________��
(4)���ݼ�¼�ʹ�����(��Ƴ��������εζ��������ݶ����������)���������ݴ������ζ������ı�����Һ���ƽ��ֵΪ20.00mL����˳�֭��ά����C�ĺ�����___________mg��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���̶��ݻ����ܱ������У�����һ���¶Ƚ������·�Ӧ��H2(g)��Br2(g)![]() 2HBr(g)����֪����1 mol H2��2 mol Br2�ﵽƽ�������xmol HBr������ͬ����������ʼʱ�����H2��Br2��HBr�ֱ�Ϊa��b��c(����Ϊ0)�ұ���ƽ��ʱ������ֺ��������䣬�����ƶ���ȷ����(����)
2HBr(g)����֪����1 mol H2��2 mol Br2�ﵽƽ�������xmol HBr������ͬ����������ʼʱ�����H2��Br2��HBr�ֱ�Ϊa��b��c(����Ϊ0)�ұ���ƽ��ʱ������ֺ��������䣬�����ƶ���ȷ����(����)
��a��b��cӦ����Ĺ�ϵ��4a��c��2b
��ƽ��ʱHBrΪxmol
��a��b��cӦ����Ĺ�ϵ��a��b��c
��ƽ��ʱHBrΪ![]() xmol
xmol
A.��B.�٢�C.�٢�D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ƾ���(Na2S2O3��5H2O)�������մ�����������ˮ���������Ҵ��������Ի������Һ�н��ȶ����㷺Ӧ�����ճ����������С�����ͼ��ʾװ����ͨ��SO2���ڼ��������·�Ӧ���Ƶ�Na2S2O3��5H2O��


�ش��������⣺
(1)S2O32-�ṹʽ��ͼ��ʾ������S*�Ļ��ϼ�Ϊ_________��
(2)��ƿ�з�����Ӧ�����ӷ���ʽΪ_________________________��
(3)25��ʱ������ҺpH�ӽ�7ʱ��������ֹͣͨSO2��ԭ����____________________��(�����ӷ���ʽ��ʾ)
(4)��Ӧ��ֹ������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ������һϵ�в����ɵ�Na2S2O3��5H2O���塣����ϴ�Ӽ���ѡ��____________��(����)
A��ˮ B���Ҵ� C��ϡ���� D������������Һ
(5)ȷ��ȡ1.4g��Ʒ���������в���ȴ����ˮ20mL��ʹ����ȫ�ܽ⣬�Ե�����ָʾ������0.1000mol��L-1����ˮ��Һ�ζ�����֪��2S2O32-+I2(aq)=S4O62-(��ɫ)+2I-(aq)��

������ˮӦʢ����_______(���ʽ����ʽ��)�ζ����С�
�ڵ�һ�εζ���ʼ�ͽ���ʱ���ζ����е�Һ������ͼ��ʾ�����һ�����ĵ�ˮ����Һ�����Ϊ_____mL��

���ظ������������Σ���¼�������������±������Ʒ��Na2S2O3��5H2O����������Ϊ_______����(����1λС��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ظ������Һ�д�������ƽ�⣺Cr2O72-(�Ⱥ�ɫ)+H2O![]() 2H++2CrO42-(��ɫ)����K2Cr2O7��Һ�м������������Լ�����Һ��ɫ��ӻ�ɫ��Ϊ�Ⱥ�ɫ
2H++2CrO42-(��ɫ)����K2Cr2O7��Һ�м������������Լ�����Һ��ɫ��ӻ�ɫ��Ϊ�Ⱥ�ɫ
A.NaHSO4B.NaHCO3C.Na2CO3D.CH3COONa
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Cl2����ijЩ�����л���ʱ�����������HCl���������·�Ӧ����ʵ���ȵ�ѭ�����ã�4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ��H=-115.6 kJ��mol-1
2Cl2(g)+2H2O(g) ��H=-115.6 kJ��mol-1

����˵����ȷ����
A. �����¶������HCl��ת����
B. �����������ʹ�÷��˵��ʱ��С
C. 1molCl2ת��Ϊ2molCl2ԭ�ӷų�243kJ����
D. ����H2O(g)��1mol H-O���ȶ���HCl(g)��1mol H-Cl������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com