
【题目】维生素C的分子式是C6H8O6,水溶液呈酸性,高温或较长时间受热易损耗,许多新鲜水果、蔬菜、乳制品中都含有丰富的维生素C,例如:新鲜橙汁中含维生素C浓度在500mg·L-1左右。某校化学课外活动小组进行测定果汁中维生素C含量实验,下面是他们的实验过程及分析报告,请根据此报告填写有关空白。
Ⅰ实验目的:测定××牌软包装鲜橙汁维生素C含量。
Ⅱ实验原理:C6H8O6+I2→C6H6O6+2H++2I-。
Ⅲ实验用品和试剂:
①仪器和用品(自选,略)
②试剂:浓度为7.50×10-3mol·L-1的标准碘(水)溶液,指示剂,蒸馏水等。
Ⅳ实验过程:
(1)洗涤仪器,检查是否漏液,用标准液润洗后装好标准液待用。在此步操作中,需用标准液润洗的仪器是_____________。
(2)打开橙汁包,目测:颜色-橙黄色,澄清度-好,将仪器____________盛装该橙汁润洗2~3遍,移取20.00mL橙汁入锥形瓶,向瓶中加入2滴指示剂,该指示剂的名称是____________。
(3)用左手操作滴定管,右手摇动锥形瓶,眼睛注视___________。滴定至终点时的现象是__________。
(4)数据记录和处理:(设计出表格,将三次滴定所得数据都填入表格中),若经数据处理,滴定中消耗标准碘溶液体积平均值为20.00mL,则此橙汁中维生素C的含量是___________mg·L-1。
【答案】酸式滴定管 碱式滴定管 淀粉溶液 锥形瓶 溶液由无色变为蓝色,且半分钟颜色不恢复 1320
【解析】
根据滴定管的构造及所盛试剂的性质分析用哪种滴定管;根据滴定原理及碘水的性质分析选择指示剂及滴定终点的现象;根据滴定反应原理由标准液的浓度及实验数据计算待测液的浓度。
(1)标准液为碘水,碘水对橡胶管具有腐蚀性,所以应用酸式滴定管存放,故需用标准液润洗的仪器是酸式滴定管;故答案为:酸式滴定管;
(2)标准液存放在酸式滴定管中,则待测的橙汁应该用碱式滴定管移取,淀粉遇碘变蓝,所以可以用淀粉溶液作为指示剂,故答案为:碱式滴定管;淀粉溶液;
(3)用左手操作滴定管,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化。滴定至终点时的现象是最后一滴标准液滴入,溶液由无色变为蓝色,且半分钟不褪色,故答案为: 锥形瓶;溶液由无色变为蓝色,且半分钟颜色不恢复;
(4)20mL标准碘溶液含有碘的质量为254g/mol×0.02L×7.5×103molL1=38.1mg,设20.0mL待测橙汁中维生素C的质量为x,
根据C6H8O6+I2→C6H6O6+2H++2I-计算得:x=![]() =26.4mg,则1L中含维生素C的质量为26.4mg×
=26.4mg,则1L中含维生素C的质量为26.4mg×![]() =1320mg,所以,则此橙汁中维生素C的含量是1320mg/L,故答案为:1320。
=1320mg,所以,则此橙汁中维生素C的含量是1320mg/L,故答案为:1320。


科目:高中化学 来源: 题型:
【题目】我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是

A. 放电时,a电极反应为
B. 放电时,溶液中离子的数目增大
C. 充电时,b电极每增重![]() ,溶液中有
,溶液中有![]() 被氧化
被氧化
D. 充电时,a电极接外电源负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是
A.反应物的总能量低于生成物的总能量时,该反应一定不能发生
B.强酸跟强碱反应放出的热量一定是中和热
C.由石墨比金刚石稳定可知:C(金刚石,s)===C(石墨,s) ΔH<0
D.在101 kPa、25℃时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则表示氢气燃烧热的热化学方程式可表示为: 2 H2(g)+O2(g)===2 H2O(l) ΔH=-571.6 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业产生的废气COx、NOx、SOx对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
(1)已知甲烷的燃烧热为890 kJ/mol;1 mol水蒸气变成液态水放热44 kJ;N2与O2反应生成NO的过程如下:
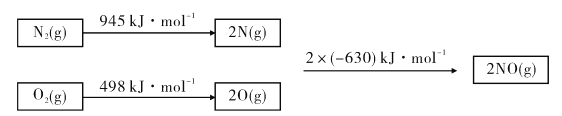
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=_______.
(2)汽车尾气中含有CO和NO,某研究小组利用反应:2CO(g)+2NO(g) ![]() N2 (g)+2CO2 (g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO和NO,能自发进行上述反应,测得不同时间的NO和CO的浓度如下表:
N2 (g)+2CO2 (g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO和NO,能自发进行上述反应,测得不同时间的NO和CO的浓度如下表:
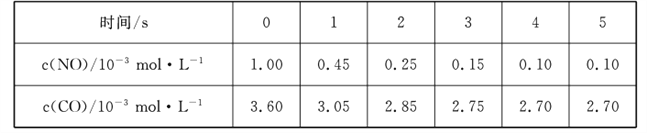
①0~2 s内用N2表示的化学反应速率为____,该温度下,反应的平衡常数K1_____。
②若该反应在绝热恒容条件下进行,则反应达到平衡后体系的温度为T2℃,此时的化学平衡常数为K2,则K1____K2(填“>”、“<”或“=”),原因是________
(3)向甲、乙两个容积均为1 L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2 mol SO2、1 mol O2,乙充入1 mol SO2、0.5 mol O2),发生反应:2SO2(g)+O2 (g) ![]() 2SO3 (g) △H= -197. 74 kJ/mol ,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如右图所示。下列说法正确的是______
2SO3 (g) △H= -197. 74 kJ/mol ,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如右图所示。下列说法正确的是______
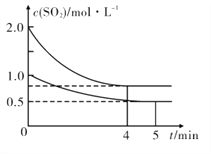
A.放出的热量Q:Q(甲)>2Q(乙)
B.体系总压强p:p(甲)>2p(乙)
C.甲容器达到化学平衡时,其化学平衡常数为4
D.保持其他条件不变,若起始时向乙中充入0.4 mol SO2、0.2mol O2、0.4 molSO3,则此时v(正>v(逆)
(4)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如右图所示。
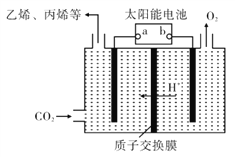
①该工艺中能量转化方式主要有____。
②电解时,生成乙烯的电极反应式是____。
(5)CO2在自然界循环时可与CaC03反应,Ca-CO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2 CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2 CO3溶液混合,若Na2 C03溶液的浓度为2×10-4 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~F均为中学化学常见的物质,它们之间存在如下转化关系,其中C和D的稀溶液不反应,B、C与D反应还可生成A(产物水等略去)。下列说法错误的是

A.铂丝蘸取A溶液灼烧,焰色反应显蓝绿色
B.D的浓溶液有强氧化性
C.E是一种有毒气体,不能用作食品添加剂
D.A的溶液电解时,阳极反应式为4OH--4e-=2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,分别向20.00mL 0.10mol·L-1的氨水、醋酸铵溶液中滴加0.10mol·L-1的氢碘酸,溶液pH与加入氢碘酸体积的变化关系如图所示。下列说法正确的是
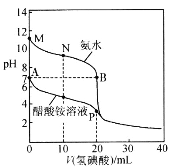
A.A点与B点由水电离产生的氢氧根浓度A点大于B点
B.M点,c(NH3·H2O)>c(OH-)>c(H+)>c(NH4+)
C.N点,c(I-)=c(NH3·H2O)+c(NH4+)
D.P点,c(H+)+c(CH3COOH)=c(OH-)+c(I-)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中加入一定物质的量的A气体,发生反应aA(g)![]() bB(g)+cC(g),达平衡后,保持温度不变,将容器体积扩大为原来的一倍,当达到新的平衡时,c(A)变为原平衡的40%,下列说法正确的是( )
bB(g)+cC(g),达平衡后,保持温度不变,将容器体积扩大为原来的一倍,当达到新的平衡时,c(A)变为原平衡的40%,下列说法正确的是( )
A.化学计量数之间的关系:a>b+cB.物质B的质量分数减小
C.平衡向正反应方向移动D.平衡移动过程中,与原平衡相比v正增大、v逆减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下分别向20.00 mL 0.1000 mol·L-1的氨水、醋酸铵溶液中滴加0.1000mol·L-1的盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法正确的是

A. M点溶液中c (OH-)>c(NH4+)>c(NH3·H2O)>c(H+)
B. N点溶液中c(NH4+)>c(NH3·H2O)>c(Cl-)>c(OH-)
C. P点溶液中c(NH4+)>2c(CH3COO-)+c(NH3·H2O)
D. Q点溶液中2c(Cl-)>c(CH3COOH)+c(NH4+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com