
����Ŀ����������ת����ϵ���ش����⣺

��֪������CH3Br![]() CH3��HBr��
CH3��HBr��
��C���ʱ�����һ±����ֻ�����֡�
(1)д��B���ʵ�����__________��D���ʵĽṹ��ʽ________��
(2)д����Ӧ��������________����Ӧ��������________��
(3)д����Ӧ���Ļ�ѧ����ʽ��________________________________��
(4)д��D��E��Ӧ�Ļ�ѧ����ʽ��_______________��
(5)��Ӧ�����п�������һ��C16H18���л���䱽����һ±����Ҳֻ�����֣�д�����Ľṹ��ʽ��_______________________________��
���𰸡�(1)1,2��������
![]()
(2)ȡ����Ӧ��NaOH����Һ������
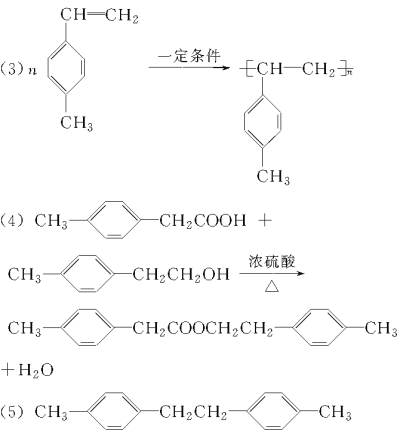
����������C�ȼױ�������̼ԭ�ӣ���Ϸ�Ӧ����������Ϣ��֪��AΪ��ϩ��BΪ1,2�������顣��C�ı�����һ±����ֻ�����֣�������ȡ�������ڶ�λ��C�ĽṹΪ��![]() ��C��D��EΪ±������ˮ��(�õ���)���������õ��ᡣ�Ƚ�C��G�ķ���ʽ��֪��C��F��G��Ϊ±������ȥ��Ӧ���ټӾ۷�Ӧ���õ��߷��ӻ����
��C��D��EΪ±������ˮ��(�õ���)���������õ��ᡣ�Ƚ�C��G�ķ���ʽ��֪��C��F��G��Ϊ±������ȥ��Ӧ���ټӾ۷�Ӧ���õ��߷��ӻ����
(5)��������һ����1,2���������������Ӽױ�����������Ϣ�ķ�Ӧ���Ҿ�Ϊ����λ����뷴Ӧ��


 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ȼ���е������٣���;�dz��㷺��ͨ���Ի����Ϊԭ����ȡ�����飬����������ͼ��ʾ��
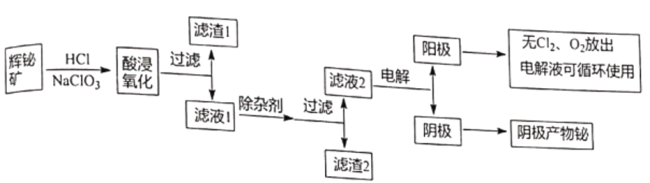
��֪���ٻ������Ҫ�ɷ���Bi2S3����������Bi2O3��SiO2�����������������ȡ�
��Bi2O3�������ᣬNaBiO3������ˮ��
�۳����£�Ksp[Fe(OH)3]=4��10-38,Ksp[Bi (OH)3]=4��10-30��Ksp[Fe(OH)2]=8.0��10-16��
�ش��������⣺
��1��д���������ʱBi2S3�����������ʵĻ�ѧ����ʽ_______________��
��2������1�ijɷ�Ϊ_______________��
��3�����Ӽ�������a.������ҺpH,b_______________��д��һ������߲�������ij��Ӽ�_______________��
��4����Һ2���������Ʊ�NaBiO3,������Һ2�м���NaOH��NaClO��Һ��ȡNaBiO3,д���÷�Ӧ�����ӷ���ʽ_______________��
��5����Һ2���õ�ⷨ��ȡ�����鵥�ʣ��������ﴦ����ɼ���ѭ��ʹ�ã����װ����ͼ��ʾ��
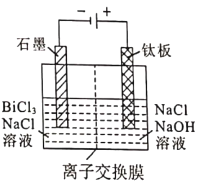
�ٽ���Ĥ����Ϊ_______________���Cl-����OH-��)����Ĥ��
�������缫��ӦʽΪ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��װ�ô�����ǣ� ��
A.��Ȳ����ȡ���ռ� B.����������Ӧ
B.����������Ӧ
C.������������ȡ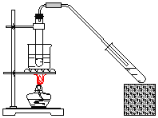 D.��ϩ����ȡ
D.��ϩ����ȡ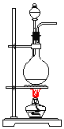
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ����NaOH����Һ�ζ�δ֪Ũ�ȵ����ᣬ����������ʵ�飺
��ʵ�鲽�裺������գ�
��1���ζ�����ʹ��ǰӦ�ȼ����Ƿ�©Һ��Ȼ��������ˮϴ�ӣ������____��ϴ��
��2��������������Һװ��ζ����ų����ݲ�����Һ�档���Һ���ʼλ����ͼ��ʾ�����ʱ�Ķ���Ϊ____mL��
![]()
��3��ȡ15.00mL��������װ����ƿ�У��μ�2�η�̪��ָʾ�����ζ��DZߵα�ҡ����ƿ���۾�Ӧ�۲�____��ѡ���ţ���
a���ζ�����Һ��ı仯 b����ƿ����Һ��ɫ�ı仯
��ʵ���¼��
ʵ����� | �������������mL�� | ������������Һ�����mL�� | ||
������ | ĩ���� | ������� | ||
1 | 15.00 | 0.50 | 17.75 | ____ |
2 | 15.00 | 0.05 | 16.10 | 16.05 |
3 | 15.00 | 0.00 | 15.95 | 15.95 |
��4������д1�鷴Ӧ���ĵ�����������Һ�����
�����ݴ��������ۣ�
��5����������ʱӦ��ȥ������Թ�����쳣���ݣ����µ�������NaOH��Һ��ƽ������ֵ��___mL����NaOH����Һ��Ũ��Ϊ0.1020mol/L���������Ũ��Ϊ___mol/L��
��6���ڱ�ʵ������У����в����������ʵ��������___��ѡ���ţ���
a����ƿ�м��������Һ���ټ���������ˮ
b����ƿ�ڵζ�ʱ����ҡ����������Һ�彦��
c������ָʾ������ɫ�б仯��ֹͣ�ζ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ�Ʒ���һ�ּ�����ҩ��ṹ���£������й������в���ȷ���ǣ�������
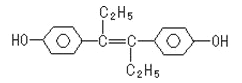
A. ���������л��ܼ�
B. ����NaOH��NaHCO3������Ӧ
C. 1mol���л��������5molBr2������Ӧ
D. ���л�������У�������16��̼ԭ�ӹ�ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڰ�����व�ͭ��������л����Գƺϳ�������յ�ЧӦ����ṹ��ʽ��ͼ����ʾ��
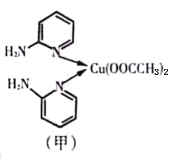
(1)��̬Cuԭ�ӵļ۵����Ų�ʽΪ__________________����Ԫ�����ڱ���ͭλ��_____��(�s������P������d����ds��)
(2)C��N��O��һ�������ɴ�С��˳��Ϊ________________��
(3)�ڰ�����व�ͭ������У�Cu2+����λ����___________��Nԭ�ӵ��ӻ�����Ϊ_____________��
(4)��ͼ����ʾ��Fe3O4�������У�O2-Χ�����������϶(1��3��6��7����Χ��)�����������϶(3��6��7��8��9��12����Χ��)��Fe3O4����һ���Fe3+��������������϶�У�Fe2+����һ��Fe3+��������������϶�У����������������϶�����������϶��֮��Ϊ___________����_______________%�����������϶û����������ӡ�
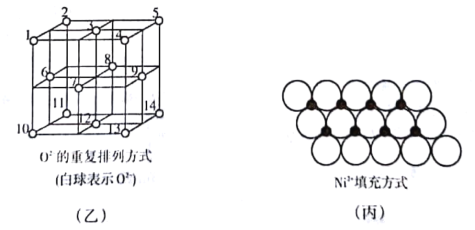
(5)һ���¶��£�NiO��������Է��ط�ɢ���γɡ������Ӳ㡱��������ΪO2-�����õ������У�Ni2+�������(��ͼ��)����֪O2-�İ뾶Ϊa nm��ÿƽ��������Ϸ�ɢ�ĸþ��������Ϊ________g(��a��NA��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС������NaI��Һ��ͨ������Cl2�õ������Һ�������ú����Һ��ȡNaI���壬ʵ���������£�

��֪��Ӧ����2I��+2Cu2++![]() +H2O
+H2O![]() 2CuI��+
2CuI��+![]() +2H+��
+2H+��
�ش��������⣺
��1������ʵ������Ҫ�IJ�����������ͨ©�����ձ���_____________��
��2����Ӧ����CuI����������ԭ����ֻ��NO2���÷�Ӧ�Ļ�ѧ����ʽΪ_________________������95.5 g CuI���뷴Ӧ������Ҫ�����______________L��O2���ܽ����ɵ�NO2��ˮ����ȫת��Ϊ���ᡣ
��3��������B�к�����Ԫ�أ���ԭ������һ��Ԫ��ԭ�ӵ����ʵ���֮��Ϊ3��8������B�Ļ�ѧʽΪ_____________��
��4����Ӧ�������ɺ�ɫ�������ɫ���壬��ɫ������׳�Ϊ��������������Ӧ���Ļ�ѧ����ʽΪ______��
��5����������Cl2ͨ�뺬12 g NaI����Һ�У�һ��ʱ������Һ���ɵõ����������Ϊ_________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�һ�����ܱ������У����淴ӦA(g)+B(g)![]() xC(g)������ͼ��ʾ�Ĺ�ϵ���ߣ�������ͼ�����ж���ȷ���ǣ� ��
xC(g)������ͼ��ʾ�Ĺ�ϵ���ߣ�������ͼ�����ж���ȷ���ǣ� ��
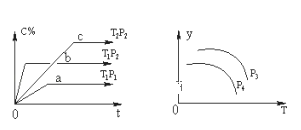
A.p3��p4��y���ʾA�����ʵ�������
B.������A��Ũ�ȣ�ƽ����ϵ��ɫ���Cһ��������ɫ������
C.p3��p4��y���ʾƽ�ⳣ��K
D.p3>p4��y���ʾ��������ƽ��Ħ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ����Ҫ�Ļ���ԭ�ϣ�����ϩΪԭ���ڲ�ͬ�����¿ɺϳ��������ʣ���������δ�������
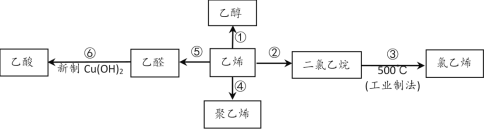
������Ҫ��д����
��1������ϩ�Ľṹ��ʽ��_____��
��2����Ӧ�ڵĻ�ѧ����ʽ��____����Ӧ������___��
��3����Ӧ�Ļ�ѧ����ʽ��____��ʵ��������____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com