
ЎҫМвДҝЎҝҪрКфойФЪЧФИ»ҪзЦРөДБҝј«ЙЩЈ¬УГНҫ·ЗіЈ№г·әЈ¬НЁіЈТФ»ФойҝуОӘФӯБПМбИЎҪрКфойЈ¬№ӨТХБчіМИзНјЛщКҫЈә
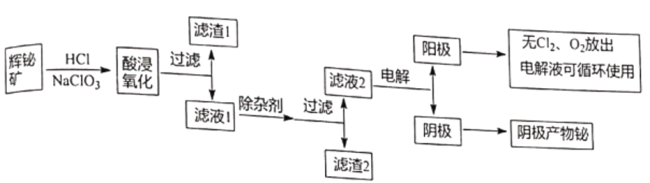
ТСЦӘЈәўЩ»ФойҝуЦчТӘіЙ·ЦКЗBi2S3Ј¬»№ә¬ЙЩБҝBi2O3ЎўSiO2ЎўМъөДСх»ҜОпәНБт»ҜОпөИЎЈ
ўЪBi2O3ДЬИЬУЪЛбЈ¬NaBiO3І»ИЬУЪЛ®ЎЈ
ўЫіЈОВПВЈ¬Ksp[Fe(OH)3]=4ЎБ10-38,Ksp[Bi (OH)3]=4ЎБ10-30Ј»Ksp[Fe(OH)2]=8.0ЎБ10-16Ј»
»ШҙрПВБРОКМвЈә
ЈЁ1Ј©РҙіцЛбҪюСх»ҜКұBi2S3ұ»Сх»ҜіЙБтөҘЦКөД»ҜС§·ҪіМКҪ_______________ЎЈ
ЈЁ2Ј©ВЛФь1өДіЙ·ЦОӘ_______________ЎЈ
ЈЁ3Ј©іэФУјБөДЧчУГa.өчҪЪИЬТәpH,b_______________Ј¬РҙіцТ»ЦЦДЬМбёЯІъОпІъБҝөДіэФУјБ_______________ЎЈ
ЈЁ4Ј©ВЛТә2»№ҝЙУГАҙЦЖұёNaBiO3,ҝЙПтВЛТә2ЦРјУИлNaOHәНNaClOИЬТәЦЖИЎNaBiO3,РҙіцёГ·ҙУҰөДАлЧУ·ҪіМКҪ_______________ЎЈ
ЈЁ5Ј©ВЛТә2ІЙУГөзҪв·ЁЦЖИЎҪрКфойөҘЦКЈ¬Сфј«ІъОпҙҰАнәуҝЙјМРшСӯ»·К№УГЈ¬өзҪвЧ°ЦГИзНјЛщКҫЎЈ
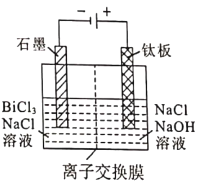
ўЩҪ»»»ДӨАаРНОӘ_______________ЈЁМоЎ°Cl-Ўұ»тЎ°OH-Ўұ)Ҫ»»»ДӨЎЈ
ўЪСфј«өзј«·ҙУҰКҪОӘ_______________ЎЈ
Ўҫҙр°ёЎҝBi2S3+6HCl+NaClO3=2BiCl3+NaCl+3SЎэ+3H2O SәНSiO2 іэИҘФУЦКFe3+ Bi2O3»тBi(OH)3 Na++Bi3++C1O-+4OH-=NaBiO3Ўэ+Cl-+2H2O Cl- Cl-+6OH--6e-=ClO3-+3H2O
ЎҫҪвОцЎҝ
»ФойҝуЛбҪюСх»Ҝәу№эВЛЈ¬өГөҪВЛФь1ОӘІ»ИЬУЪЛбөД¶юСх»Ҝ№иәНBi2S3ұ»Сх»ҜәуЙъіЙөДБтөҘЦКЈ¬ВЛТә1ЦРә¬УРBiCl3ЎўNaClЈ¬FeCl3өИЈ¬ОӘБЛұЬГвТэИлРВФУЦКЈ¬ФтјУИлөДіэФУКФјБҝЙТФКЗBi2O3»тBi(OH)3Ј¬ДҝөДКЗөчҪЪpHК№МъАлЧУЧӘ»ҜіЙЗвСх»ҜМъіэИҘЈ¬ВЛТә2ЦРөДЦчТӘіЙ·ЦОӘВИ»ҜДЖәНBiCl3Ј¬ҫӯөзҪвөГөҪойөҘЦКЎЈ
ЈЁ1Ј©ЛбҪюСх»ҜКұBi2S3ұ»Сх»ҜіЙБтөҘЦКөД»ҜС§·ҪіМКҪОӘBi2S3+6HCl+NaClO3=2BiCl3+NaCl+3SЎэ+3H2OЈ¬№Кҙр°ёОӘЈәBi2S3+6HCl+NaClO3=2BiCl3+NaCl+3SЎэ+3H2OЈ»
ЈЁ2Ј©УЙ·ЦОцЦӘЈ¬ВЛФь1өДіЙ·ЦОӘSәНSiO2Ј¬№Кҙр°ёОӘЈәSәНSiO2Ј»
ЈЁ3Ј©УЙ·ЦОцЦӘЈ¬ҝЙУГBi2O3»тBi(OH)3өчҪЪpHК№МъАлЧУЧӘ»ҜіЙЗвСх»ҜМъіБөніэИҘЈ¬№Кҙр°ёОӘЈәіэИҘФУЦКFe3+Ј»Bi2O3»тBi(OH)3Ј»
ЈЁ4Ј©ВЛТә2ЦРөДЦчТӘіЙ·ЦОӘВИ»ҜДЖәНBiCl3Ј¬јУИлNaOHәНNaClOИЬТәЦЖИЎNaBiO3Кұ·ўЙъ·ҙУҰөДАлЧУ·ҪіМКҪОӘNa++Bi3++C1O-+4OH-=NaBiO3Ўэ+Cl-+2H2OЈ¬№Кҙр°ёОӘЈәNa++Bi3++C1O-+4OH-=NaBiO3Ўэ+Cl-+2H2OЈ»
ЈЁ5Ј©ўЩВИАлЧУОӘТхАлЧУЈ¬өзҪвКұЈ¬ВИАлЧУФЪСфј«·ЕөзЈ¬ВИАлЧУТЖПтСфј«Ј¬ФтҪ»»»ДӨАаРНОӘCl-Ҫ»»»ДӨЈ¬№Кҙр°ёОӘЈәCl-Ј»
ўЪСфј«өзј«ёҪҪьВИАлЧУ·ЕөзЧӘ»ҜОӘВИЛбёщЈ¬өзј«·ҙУҰКҪОӘCl-+6OH--6e-=ClO3-+3H2OЈ¬№Кҙр°ёОӘЈәCl-+6OH--6e-=ClO3-+3H2OЎЈ



| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝёщҫЭИзНјЛщКҫөД·ҙУҰЕР¶ППВБРЛө·ЁЦРҙнОуөДКЗ
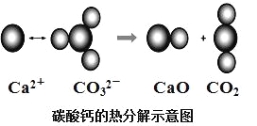
A. CO2(g)әНCaO(s)өДЧЬДЬБҝҙуУЪCaCO3(s)өДЧЬДЬБҝ
B. ёГ·ҙУҰөДмКұдҙуУЪБг
C. ёГ·ҙУҰЦРУРАлЧУјь¶ПБСТІУР№ІјЫјь¶ПБСЈ¬»ҜС§јь¶ПБСОьКХДЬБҝЈ¬»ҜС§јьЙъіЙ·ЕіцДЬБҝ
D. УЙёГ·ҙУҰҝЙНЖіц·ІКЗРиТӘјУИИІЕ·ўЙъөД·ҙУҰҫщОӘОьИИ·ҙУҰ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝК№УГөЁ·Ҝ(CuSO45H2O)ЕдЦЖ0.1mol/LөДБтЛбНӯИЬТәЈ¬ХэИ·өДІЩЧчКЗ_______
A.Ҫ«өЁ·ҜјУИИіэИҘҪбҫ§Л®әуЈ¬іЖИЎ16gИЬҪвФЪ1LЛ®ЦР
B.іЖИЎ25gөЁ·ҜИЬУЪЛ®Ј¬И»әуҪ«ҙЛИЬТәПЎКНЦБ1L
C.іЖИЎ25gөЁ·ҜИЬҪвФЪ1LЛ®Ап
D.Ҫ«16gөЁ·ҜИЬУЪЛ®Ј¬И»әуҪ«ҙЛИЬТәПЎКНЦБ1L
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ№ӨТөЙПСРҫҝёЯР§ҙҰАнГәИјЙХКН·ЕіцАҙөДSO2Ј¬УРАыУЪјхРЎ»·ҫіОЫИҫЎЈФЪTЎжКұЈ¬АыУГCOҙҰАнSO2өД·ҙУҰОӘЈә2CO(g)+SO2(g)![]() 2CO2(g)+S(l) ЎчH=akJ/molЈ»
2CO2(g)+S(l) ЎчH=akJ/molЈ»
ЈЁ1Ј©ТСЦӘTЎжКұЈәC(s)+![]() O2(g)=CO(g) ЎчH1=-110.5kJ/mol
O2(g)=CO(g) ЎчH1=-110.5kJ/mol
S(l)+O2(g)=SO2(g) ЎчH2=-290.0kJ/mol
C(s)+O2(g)=CO2(g) ЎчH3=-390.0kJ/mol
ФтTЎжКұЈ¬a=___ЎЈ
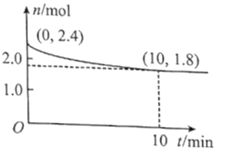
ЈЁ2Ј©ФЪTЎжПВЈ¬Ҫ«1.4molCOәН1molSO2НЁИл2LәгИЭИЭЖчЦР·ўЙъЙПКц·ҙУҰЈ¬·ҙУҰМеПөЖшМеЧЬОпЦКөДБҝЛжКұјдұд»ҜИзНјЈ»ФЪ0~10minЈ¬·ҙУҰөДЖҪҫщЛЩВКv(CO)=___Ј¬SO2өДЖҪәвЧӘ»ҜВК![]() (SO2)=___%Ј»ФЪTЎжКұёГ·ҙУҰөДЖҪәвіЈКэKc=___L/molЎЈ
(SO2)=___%Ј»ФЪTЎжКұёГ·ҙУҰөДЖҪәвіЈКэKc=___L/molЎЈ
ЈЁ3Ј©КөСйІвөГЈәvХэ=v(CO)ПыәД=kХэc(CO)c(SO2)Ј¬vДж=v(CO2)ПыәД=kДж![]() Ј¬kХэЎўkДжОӘЦ»КЬОВ¶ИУ°ПмөДЛЩВКіЈКэЎЈИфҪ«ЈЁ2Ј©ЦРИЭЖчДЪөДОВ¶ИЙэёЯЈЁјЩЙиёчОпЦКөДЧҙМ¬І»·ўЙъұд»ҜЈ©Ј¬
Ј¬kХэЎўkДжОӘЦ»КЬОВ¶ИУ°ПмөДЛЩВКіЈКэЎЈИфҪ«ЈЁ2Ј©ЦРИЭЖчДЪөДОВ¶ИЙэёЯЈЁјЩЙиёчОпЦКөДЧҙМ¬І»·ўЙъұд»ҜЈ©Ј¬![]() өДЦөҪ«___ЈЁМоЎ°ФцҙуЎұЎўЎ°јхРЎЎұ»тЎ°І»ұдЎұ)ЎЈ
өДЦөҪ«___ЈЁМоЎ°ФцҙуЎұЎўЎ°јхРЎЎұ»тЎ°І»ұдЎұ)ЎЈ
ЈЁ4Ј©ДіҝЖСРНЕ¶УСРҫҝУГFe2(SO4)3(aq)ҙҰАнSO2ЈәFe3+ИЬТәОьКХSO2·ўЙъөДАлЧУ·ҙУҰ·ҪіМКҪОӘ___Ј»ЖдЛыНвҪзМхјюІ»ұдПВЈ¬ФЪПаН¬КұјдДЪОВ¶И¶ФSO2ОьКХВКөДУ°ПмҪб№ыИзНјЈ¬ФЪ40ЎжЗ°Ј¬SO2өДОьКХВКЛжОВ¶Иұд»ҜөДҝЙДЬФӯТтКЗ___Ј»ФЪ40ЎжәуЈ¬SO2өДОьКХВК·ўЙъөДұд»ҜКЗОВ¶ИЙэёЯёГ·ҙУҰДжПтТЖ¶ҜөДҪб№ыЈ¬өјЦВ·ҙУҰДжПтТЖ¶ҜөДФӯТтЈәТ»КЗёГ·ҙУҰОӘ·ЕИИ·ҙУҰЈ¬¶юКЗ___ЎЈ
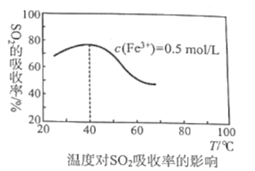
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДі»ҜС§РЛИӨРЎЧйУГПВГжЛщКҫЧ°ЦГЦЖИЎВИЛбјШЎўҙОВИЛбДЖәНВИЛ®ІўҪшРРМҪҫҝКөСйЎЈ
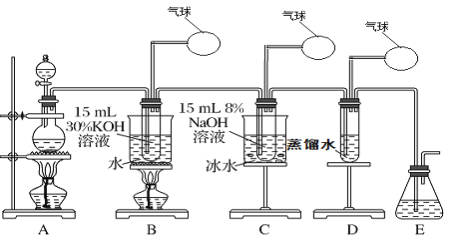
КөСйўс.ЦЖИЎВИЛбјШЈЁKClO3Ј©ЎўҙОВИЛбДЖЎўВИЛ®
ЈЁ1Ј©РҙіцЧ°ЦГAКөСйКТЦЖИЎCl2өД»ҜС§·ҙУҰ·ҪіМКҪ_________________________
ЈЁ2Ј©ЦЖИЎКөСйҪбКшәуЈ¬ИЎіцЧ°ЦГBЦРөДКФ№ЬЈ¬АдИҙҪбҫ§Ўў№эВЛЎўПҙөУЈ¬ёГКөСйІЩЧч№эіМРиТӘөДІЈБ§ТЗЖчУРҪәН·өО№ЬЎўЙХұӯЎў________Ўў________ЎЈ
ЈЁ3Ј©РҙіцBЦРЦЖұёВИЛбјШЈЁKClO3Ј©өД·ҪіМКҪ____________________
ЈЁ4Ј©Ч°ЦГCЦР·ҙУҰРиТӘФЪұщЛ®ФЎЦРҪшРРЈ¬ЖдФӯТтКЗ_____________________________
ЧКБПЈәSO2КЗТ»ЦЦЛбРФСх»ҜОпЈ¬УлCO2ПаЛЖЈ¬2NaOH(№эБҝ)+SO2=Na2SO3+H2O ,SO32-КЗ»№ФӯРФәЬЗҝөДАлЧУЈ¬ФЪИЬТәЦРУлСх»ҜРФЗҝөДАлЧУІ»ДЬҙуБҝ№ІҙжЈ¬ТЧұ»Сх»ҜіЙSO42ЎӘЎЈ
КөСйўт.ОІЖшҙҰАн
КөСйРЎЧйАыУГёХОьКХ№эЙЩБҝSO2өДNaOHИЬТә¶ФЖдОІЖшҪшРРОьКХҙҰАнЎЈ
ЈЁ5Ј©ОьКХОІЖшТ»¶ОКұјдәуЈ¬ОьКХТә(ЗҝјоРФ)ЦРҝП¶ЁҙжФЪClЈӯЎўOHЈӯәН![]()
ЗлЙијЖКөСйЈ¬МҪҫҝёГОьКХТәЦРҝЙДЬҙжФЪөДЖдЛыТхАлЧУ(І»ҝјВЗҝХЖшЦРөДCO2өДУ°Пм)ЎЈ
ўЩМбіцәПАнјЩЙиЈә
јЩЙи1ЈәЦ»ҙжФЪ![]() Ј»
Ј»
јЩЙи2ЈәјИІ»ҙжФЪ![]() ТІІ»ҙжФЪClOЈӯЈ»
ТІІ»ҙжФЪClOЈӯЈ»
јЩЙи3Јә______________________________ЎЈ
ўЪЙијЖКөСй·Ҫ°ёЈ¬ҪшРРКөСйЎЈЗлФЪұнЦРРҙіцКөСйІҪЦиТФј°ФӨЖЪПЦПуәНҪбВЫЎЈ
ПЮСЎКөСйКФјБЈә3molЎӨLЈӯ1 H2SO4Ўў1molЎӨLЈӯ1 NaOHИЬТәЎў0.01molЎӨLЈӯ1ЛбРФKMnO4ИЬТәЎўөн·ЫЎўKIИЬТәЎЈ
КөСйІҪЦи | ФӨЖЪПЦПуәНҪбВЫ |
ІҪЦи1ЈәИЎЙЩБҝОьКХТә·ЦЦГУЪAЎўBКФ№ЬЦР | |
ІҪЦи2ЈәПтAКФ№ЬЦРөОјУ0.01 molЎӨLЈӯ1ЛбРФKMnO4ИЬТә | (1)ИфИЬТәНКЙ«Ј¬ФтјЩЙи1іЙБў (2)ИфИЬТәІ»НКЙ«Ј¬ФтјЩЙи2»т3іЙБў |
ІҪЦи3Јә____________________________________ | __________________________________ |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ№ӨТөЙПЦЖұёҙҝ№и·ҙУҰөДИИ»ҜС§·ҪіМКҪИзПВЈәSiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) ҰӨҰ§=+QkJ/mol(Q>0)Ј¬ДіОВ¶ИЎўС№ЗҝПВЈ¬Ҫ«Т»¶ЁБҝ·ҙУҰОпНЁИлГЬұХИЭЖчҪшРРТФЙП·ҙУҰЈ¬ПВБРРрКцХэИ·өДКЗЈЁ Ј©
Si(s)+4HCl(g) ҰӨҰ§=+QkJ/mol(Q>0)Ј¬ДіОВ¶ИЎўС№ЗҝПВЈ¬Ҫ«Т»¶ЁБҝ·ҙУҰОпНЁИлГЬұХИЭЖчҪшРРТФЙП·ҙУҰЈ¬ПВБРРрКцХэИ·өДКЗЈЁ Ј©
A.·ҙУҰ№эіМЦРЈ¬ИфФцҙуС№ЗҝДЬМбёЯSiCl4өДЧӘ»ҜВК
B.Иф·ҙУҰҝӘКјКұSiCl4ОӘ1molЈ¬ФтҙпЖҪәвКұЈ¬ОьКХИИБҝОӘQkJ
C.·ҙУҰЦБ2minКұЈ¬ИфHClЕЁ¶ИОӘ0.12mol/LЈ¬ФтH2өД·ҙУҰЛЩВК0.03mol/(LЎӨmin)
D.өұ·ҙУҰОьКХИИБҝ0.25QkJКұЈ¬ЙъіЙөДHClНЁИлә¬0.1mol NaOHөДИЬТәЗЎәГ·ҙУҰ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДі»ҜС§ҝОНв»о¶ҜРЎЧйДвУГЗҰРоөзіШОӘЦұБчөзФҙЈ¬ҪшРРөзРхДэҫ»Л®өДКөСйМҪҫҝЈ¬ЙијЖөДКөСйЧ°ЦГИзНјЛщКҫЎЈПВБРЛө·ЁХэИ·өДКЗ
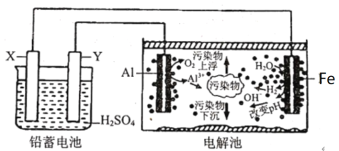
A.Yөзј«·ҙУҰОӘPb+SO42--2e-=PbSO4
B.ГҝПыәД103.5gPb, АнВЫЙПөзҪвіШТхј«ЙПУР1molH2ЙъіЙ
C.ёГөзҪвіШөДЧЬ·ҙУҰОӘ2Al+6H2O![]() 2Al(OH)3+3H2Ўь
2Al(OH)3+3H2Ўь
D.ИфОЫЛ®ОӘә¬УРCr2O72-№ӨТөЛбРФ·ПЛ®Ј¬ОӘҪ«ЖдЧӘ»ҜОӘCr3+іэИҘЈ¬ҝЙИГМъөзј«Б¬ҪУЗҰРоөзіШөДХэј«
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДіКөСйРЎЧйУГ100mL0.50mol/LNaOHИЬТәУл60mL0.50mol/LБтЛбҪшРРЦРәНИИөДІв¶ЁЎЈЧ°ЦГИзНјЛщКҫЈ¬»ШҙрПВБРОКМвЈә
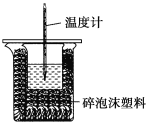
ЈЁ1Ј©ИфКөСй№ІРиТӘ400mLNaOHИЬТәЈ¬КөСйКТФЪЕдЦЖёГИЬТәКұЈ¬ФтРиТӘіЖБҝNaOH№ММе____gЎЈ
ЈЁ2Ј©НјЦРЧ°ЦГИұЙЩөДТЗЖчКЗ____ЎЈ
ЈЁ3Ј©БтЛбЙФ№эБҝөДФӯТтКЗ____ЎЈ
ЈЁ4Ј©ЗлМоРҙПВұнЦРөДЖҪҫщОВ¶ИІоЈә
КөСй ҙОКэ | ЖрКјОВ¶ИT1/Ўж | ЦХЦ№ОВ¶И T2/Ўж | ЖҪҫщОВ¶ИІо (T2ЈӯT1)/Ўж | ||
HCl | NaOH | ЖҪҫщЦө | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ____ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
ЈЁ5Ј©ҪьЛЖИПОӘ0.50 mol/L NaOHИЬТәУл0.50 mol/LБтЛбИЬТәөДГЬ¶И¶јКЗ1 g/cm3Ј¬ЦРәНәуЙъіЙИЬТәөДұИИИИЭОӘc=4.18J/(gЎж)ФтЙПКцКөСйЦРәНИИҰӨH=___ЈЁИЎРЎКэөгәуТ»О»Ј©
ЈЁ6Ј©ЙПКцКөСйҪб№ыУл57.3kJ/molУРЖ«ІоІъЙъЖ«ІоөДФӯТтҝЙДЬКЗ____
AЈ®БҝИЎNaOHИЬТәКұСцКУ¶БКэ
BЈ®ОӘБЛК№·ҙУҰід·ЦЈ¬ҝЙТФПтЛбЦР·ЦҙОјУИлјо
CЈ®КөСйЧ°ЦГұЈОВёфИИР§№ыІо
DЈ®УГНӯЛҝҙъМжІЈБ§°фҪБ°и
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝёщҫЭПВКцЧӘ»Ҝ№ШПөЈ¬»ШҙрОКМвЈә

ТСЦӘЈәўЩЈ«CH3Br![]() CH3Ј«HBrЈ»
CH3Ј«HBrЈ»
ўЪCОпЦКұҪ»·ЙПТ»ВұҙъОпЦ»УРБҪЦЦЎЈ
(1)РҙіцBОпЦКөДГыіЖ__________Ј»DОпЦКөДҪб№№јтКҪ________ЎЈ
(2)Рҙіц·ҙУҰўЪөДАаРН________Ј»·ҙУҰўЭөДМхјю________ЎЈ
(3)Рҙіц·ҙУҰўЮөД»ҜС§·ҪіМКҪЈә________________________________ЎЈ
(4)РҙіцDЈ«E·ҙУҰөД»ҜС§·ҪіМКҪЈә_______________ЎЈ
(5)·ҙУҰўЪ»№УРҝЙДЬЙъіЙТ»ЦЦC16H18өДУР»ъОпЈ¬ЖдұҪ»·ЙПТ»ВұҙъОпТІЦ»УРБҪЦЦЈ¬РҙіцЛьөДҪб№№јтКҪЈә_______________________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com