
【题目】某化学课外活动小组拟用铅蓄电池为直流电源,进行电絮凝净水的实验探究,设计的实验装置如图所示。下列说法正确的是
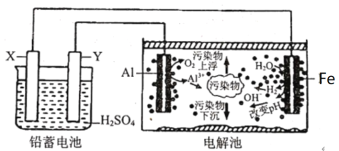
A.Y电极反应为Pb+SO42--2e-=PbSO4
B.每消耗103.5gPb, 理论上电解池阴极上有1molH2生成
C.该电解池的总反应为2Al+6H2O![]() 2Al(OH)3+3H2↑
2Al(OH)3+3H2↑
D.若污水为含有Cr2O72-工业酸性废水,为将其转化为Cr3+除去,可让铁电极连接铅蓄电池的正极
【答案】D
【解析】
据图可知电解池中,铝电极失电子作阳极,电极反应为:2Al-6e-=2Al3+,在铝表面有氧气产生,说明有部分氢氧根离子放电,Fe电极上水得电子作阴极,电极反应为:6H2O+6e-=3H2↑+6OH-,铅蓄电池中X与阴极Fe相连,作负极,负极上发生的反应是Pb+SO42--2e-=PbSO4,Y与阳极铝相连,作正极,电极反应为PbO2+4H++SO42-+2e-=PbSO4+2H2O,串联电路中各电极转移电子相等。
A.由分析可知,Y作正极,电极反应为PbO2+4H++SO42-+2e-=PbSO4+2H2O,故A错误;
B.n(Pb)= ![]() ,Pb是+2价的金属,反应的Pb的物质的量是0.5mol,则反应转移电子的物质的量是0.5mol×2=1mol,根据串联电路中电子转移守恒,则电解池的阴极上反应产生H2的物质的量是0.5mol,故B错误;
,Pb是+2价的金属,反应的Pb的物质的量是0.5mol,则反应转移电子的物质的量是0.5mol×2=1mol,根据串联电路中电子转移守恒,则电解池的阴极上反应产生H2的物质的量是0.5mol,故B错误;
C.阳极铝电极反应为:2Al-6e-=2Al3+,阴极Fe电极电极反应为6H2O+6e-=3H2↑+6OH-,总反应为2Al+6H2O ![]() 2Al(OH)3(胶体)+3H2↑,在铝的表面有氧气产生,说明还存在电解水的过程:2H2O
2Al(OH)3(胶体)+3H2↑,在铝的表面有氧气产生,说明还存在电解水的过程:2H2O ![]() O2↑+2H2↑,故C错误;
O2↑+2H2↑,故C错误;
D.让铁电极连接铅蓄电池的正极作阳极,则铁失电子转化为亚铁离子,含有Cr2O72-工业酸性废水具有强氧化性,与亚铁离子反应可转化为Cr3+除去,故D正确;
综上所述,答案为D。


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质的焰色反应都呈黄色,A、B与水反应都有气体放出,A与水反应放出的气体具有还原性,B与水反应放出的气体具有氧化性,同时都生成C的溶液,C与适量的CO2反应生成D,D溶液与过量的CO2反应生成E,E加热能生成D。
(1)写出下列物质的化学式:B____________,E_____________。
(2)写出A→C的化学方程式,并标出电子转移的方向和数目:_______________
(3)写出C→D的离子方程式:________________________________。
(4)写出E→D的化学方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容容器中,.当下列物理量不再发生变化时,不能表明反应:A(s)+3B(g)![]() 2C(g)+D(g)已达平衡状态的是( )
2C(g)+D(g)已达平衡状态的是( )
①气体的平均相对分子质量不再变化;②单位时间内生成amolA,同时消耗2amolC;③容器中的压强不再变化;④混合气体的密度不再变化;⑤B的浓度不再变化;⑥n(A):n(B):n(C):n(D)=1:3:2:2
A.②③⑤B.①③④⑥C.②④⑤D.②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铋在自然界中的量极少,用途非常广泛,通常以辉铋矿为原料提取金属铋,工艺流程如图所示:
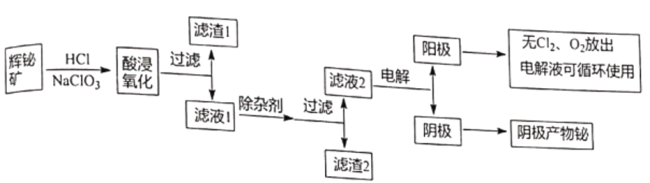
已知:①辉铋矿主要成分是Bi2S3,还含少量Bi2O3、SiO2、铁的氧化物和硫化物等。
②Bi2O3能溶于酸,NaBiO3不溶于水。
③常温下,Ksp[Fe(OH)3]=4×10-38,Ksp[Bi (OH)3]=4×10-30;Ksp[Fe(OH)2]=8.0×10-16;
回答下列问题:
(1)写出酸浸氧化时Bi2S3被氧化成硫单质的化学方程式_______________。
(2)滤渣1的成分为_______________。
(3)除杂剂的作用a.调节溶液pH,b_______________,写出一种能提高产物产量的除杂剂_______________。
(4)滤液2还可用来制备NaBiO3,可向滤液2中加入NaOH和NaClO溶液制取NaBiO3,写出该反应的离子方程式_______________。
(5)滤液2采用电解法制取金属铋单质,阳极产物处理后可继续循环使用,电解装置如图所示。
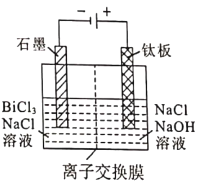
①交换膜类型为_______________(填“Cl-”或“OH-”)交换膜。
②阳极电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~111种元素在元素周期表中的位置:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |||
一 | ① | ||||||||||
二 | ② | ③ | ④ | ⑤ | |||||||
三 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||||||
四 | |||||||||||
请按要求回答下列问题:
(1)写出元素③形成单质的电子式______________
(2)画这11种元素中,非金属性最强的元素的原子结构示意图________________
(3)元素⑤④⑩分别和①形成的气体化合物中,最稳定的是(填化合物的化学式)__________
(4)元素⑨⑩的最高价氧化物的水化物中,酸性最强的是(填化合物的化学式)___________
(5)在盛有水的小烧杯中加入元素⑩的单质,发生反应的离子方程式____________________
(6)请从原子结构的角度解释,解释元素⑩的非金属性比元素强的原因_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向50mL溶有0.1molCl2的氯水中滴加2mol·L-1的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图像如图所示。下列说法正确的是( )
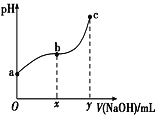
A.a点溶液中存在:N(HClO)+N(Cl-)+N(ClO-)=0.2NA(N表示粒子数),若想增加a点溶液的漂白能力可向溶液中加入碳酸钙固体
B.若a点pH=4,且c(Cl-)=m·c(ClO-),则Ka(HClO)=![]()
C.b~c段,随NaOH溶液的滴入,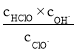 逐渐增大
逐渐增大
D.若y=200,则c点对应溶液中:c(HClO)+c(H+)=c(OH-)-2c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
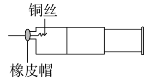
【题目】某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO。实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生。
(1)铜与稀硝酸反应的化学方程式为__。
(2)NO是大气污染物之一。目前有一种治理方法是在400℃左右、有催化剂存在的情况下,用氨气把NO还原为氮气和水。该反应的化学方程式为4NH3+6NO![]() 5N2+6H2O,每有10molN2生成,氧化产物与还原产物的物质的量之比为__。
5N2+6H2O,每有10molN2生成,氧化产物与还原产物的物质的量之比为__。
(3)N2O4为氧化剂,可以与火箭燃料偏二甲肼(C2H8N2)反应,放出巨大能量,把火箭送入太空,同时产生两种无毒气体,反应的化学方程式为__。
(4)①写出实验室由NH4Cl和Ca(OH)2加热制取氨气的化学方程式__。
②进行喷泉实验,若在水中加入酚酞,得到红色喷泉。该实验体现了氨气的两个重要性质分别是__、__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com