
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) ΔΗ=+QkJ/mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
Si(s)+4HCl(g) ΔΗ=+QkJ/mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C.反应至2min时,若HCl浓度为0.12mol/L,则H2的反应速率0.03mol/(L·min)
D.当反应吸收热量0.25QkJ时,生成的HCl通入含0.1mol NaOH的溶液恰好反应
【答案】C
【解析】
A选项,反应过程中,若增大压强,平衡逆向移动,SiCl4的转化率降低,故A错误;
B选项,若反应开始时SiCl4为1mol,则达平衡时,四氯化硅反应小于1 mol,因此吸收热量小于QkJ,故B错误;
C选项,反应至2min时,若HCl浓度为0.12mol/L,即HCl浓度该变量为0.12mol/L,H2浓度该变量为0.06 mol/L,则H2的反应速率0.03mol/(L·min),故C正确;
D选项,根据反应方程知,生成4 molHCl,吸收QkJ,当反应吸收热量0.25QkJ时,则生成1 molHCl,生成的HCl与1mol NaOH的溶液恰好反应,故D错误;
综上所述,答案为C。


科目:高中化学 来源: 题型:
【题目】下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
(1)把与下面元素有关性质相符的曲线标号填入相应的空格中:
a. 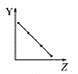 b.
b. 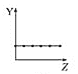 c.
c. 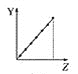 d.
d. 
①第ⅡA族元素的价电子数________。
②第三周期元素的最高化合价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①X为___________(名称),Y为____________(元素符号),Z原子结构示意图为________________。
②N的最高价氧化物的水化物的化学式为________________。
③M的最高价氧化物的化学式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯水中含有多种成分,因而具有多种性质,根据氯水分别与右图中四种物质发生的反应 (a、b、c、d重合部分代表物质间可反应,且氯水足量)。能证明氯水具有漂白性的是( )

A.aB.bC.cD.d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
Ⅰ.(1)所含铁元素既有氧化性又有还原性的物质是________(填字母)。
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合的能力,药品美蓝是其有效的解毒剂,下列说法中正确的是(_______)
A. NaNO2被氧化 B. 药品美蓝是还原剂
C. NaNO2是还原剂 D. 药品美蓝被还原
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:________________________________。
Ⅱ. 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(4)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中Na2O2是________(填“氧化剂”或“还原剂”)。
(5)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、![]() 、Cl-、H2O。
、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3∶2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:__________________________________________。
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铋在自然界中的量极少,用途非常广泛,通常以辉铋矿为原料提取金属铋,工艺流程如图所示:
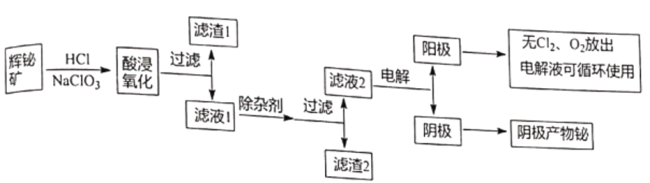
已知:①辉铋矿主要成分是Bi2S3,还含少量Bi2O3、SiO2、铁的氧化物和硫化物等。
②Bi2O3能溶于酸,NaBiO3不溶于水。
③常温下,Ksp[Fe(OH)3]=4×10-38,Ksp[Bi (OH)3]=4×10-30;Ksp[Fe(OH)2]=8.0×10-16;
回答下列问题:
(1)写出酸浸氧化时Bi2S3被氧化成硫单质的化学方程式_______________。
(2)滤渣1的成分为_______________。
(3)除杂剂的作用a.调节溶液pH,b_______________,写出一种能提高产物产量的除杂剂_______________。
(4)滤液2还可用来制备NaBiO3,可向滤液2中加入NaOH和NaClO溶液制取NaBiO3,写出该反应的离子方程式_______________。
(5)滤液2采用电解法制取金属铋单质,阳极产物处理后可继续循环使用,电解装置如图所示。
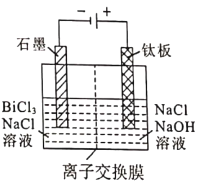
①交换膜类型为_______________(填“Cl-”或“OH-”)交换膜。
②阳极电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.01molL-1KAl(SO4)2溶液中的SO42-数目为0.02NA
B.用浓盐酸分别与MnO2、KClO3反应制备1mol氯气,转移的电子数均为2NA
C.1molNH4NO3完全溶于稀氨水中,溶液呈中性,溶液中NH4+的数目为NA
D.9.0g葡萄糖和蔗糖的混合物中含碳原子的数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向50mL溶有0.1molCl2的氯水中滴加2mol·L-1的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图像如图所示。下列说法正确的是( )
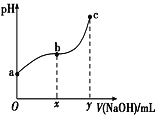
A.a点溶液中存在:N(HClO)+N(Cl-)+N(ClO-)=0.2NA(N表示粒子数),若想增加a点溶液的漂白能力可向溶液中加入碳酸钙固体
B.若a点pH=4,且c(Cl-)=m·c(ClO-),则Ka(HClO)=![]()
C.b~c段,随NaOH溶液的滴入,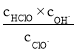 逐渐增大
逐渐增大
D.若y=200,则c点对应溶液中:c(HClO)+c(H+)=c(OH-)-2c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上合成氨反应的能量变化如图所示,该反应的热化学方程式是
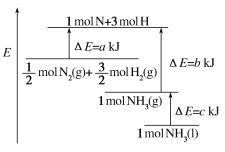
A. N2(g)+3H2(g)=2NH3(l) ΔH=2(a-b-c)kJ·mol-1
B. N2(g)+3H2(g)=2NH3(g) ΔH=2(b-a)kJ·mol-1
C. ![]() N2(g)+
N2(g)+![]() H2(g)=NH3(l) ΔH=(b+c-a)kJ·mol-1
H2(g)=NH3(l) ΔH=(b+c-a)kJ·mol-1
D. ![]() N2(g)+
N2(g)+![]() H2(g)=NH3(g) ΔH=(a+b)kJ·mol-1
H2(g)=NH3(g) ΔH=(a+b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图甲所示。
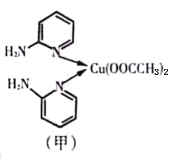
(1)基态Cu原子的价电子排布式为__________________。在元素周期表中铜位于_____区(填“s”、“P”、“d”或“ds”)
(2)C、N、O第一电离能由大到小的顺序为________________。
(3)邻氨基吡啶的铜配合物中,Cu2+的配位数是___________,N原子的杂化类型为_____________。
(4)如图乙所示,Fe3O4.晶体中,O2-围成正四面体空隙(1、3.6、7号氧围成)和正八面体空隙(3、6、7、8、9、12号氧围成),Fe3O4中有一半的Fe3+填充在正四面体空隙中,Fe2+和另一半Fe3+填充在正八面体空隙中,晶体中正四面体空隙与正八面体空隙数之比为___________,有_______________%的正八面体空隙没有填充阳离子。
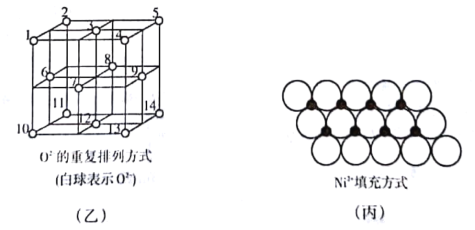
(5)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图丙),已知O2-的半径为a nm,每平方米面积上分散的该晶体的质量为________g(用a、NA表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com