
【题目】铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
Ⅰ.(1)所含铁元素既有氧化性又有还原性的物质是________(填字母)。
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合的能力,药品美蓝是其有效的解毒剂,下列说法中正确的是(_______)
A. NaNO2被氧化 B. 药品美蓝是还原剂
C. NaNO2是还原剂 D. 药品美蓝被还原
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:________________________________。
Ⅱ. 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(4)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中Na2O2是________(填“氧化剂”或“还原剂”)。
(5)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、![]() 、Cl-、H2O。
、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3∶2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:__________________________________________。
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为________mol。
【答案】C B Cu+2Fe3+=2Fe2++Cu2+ 既作氧化剂又作还原剂 2Fe(OH)3+3ClO—+ 4OH—=2FeO42—+3Cl—+5H2O 0.15
【解析】
(1)元素化合价处于中间价态时既有氧化性又有还原性;
(2)NaNO2因具有氧化性能使血红蛋白丧失与O2结合的能力,药品美蓝是其有效的解毒剂,所以药品美蓝具有还原性;
(3)FeCl3溶液与铜反应生成氯化亚铁和氯化铜;
(4)反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,Na2O2中部分氧元素化合价由-1升高为0,部分氧元素化合价由-1降低为-2;
(5)①湿法制备高铁酸钾,FeO42-为产物,Fe(OH)3为反应物,化合价升高总共3价,由电子转移守恒可知,ClO-为反应物,Cl-为生成物,化合价降低共2将,化合价升降最小公倍数为6,故Fe(OH)3的系数为2,FeO42-的系数为2,ClO-的系数为3,Cl-的系数为3;
②反应过程中氯元素化合价由+1降低为-1,Cl-是还原产物。
(1)铁元素的最高价是+3、最低价是0,单质Fe的化合价为0,只有还原性; FeCl3 中Fe的化合价为+3,只有氧化性; FeSO4中Fe的化合价为+2,既有氧化性又有还原性; Fe2O3中Fe的化合价为+3,只有氧化性;故选C。
(2)A. NaNO2具有氧化性,被还原,故A错误;
B. NaNO2因具有氧化性能使血红蛋白丧失与O2结合的能力,药品美蓝是其有效的解毒剂,所以药品美蓝具有还原性,药品美蓝是还原剂,故B正确;
C. NaNO2具有氧化性, NaNO2是氧化剂,故C错误;
D. 药品美蓝是还原剂,被氧化,故D错误。
(3)FeCl3溶液与铜反应生成氯化亚铁和氯化铜,反应的离子方程式是Cu+2Fe3+=2Fe2++Cu2+;
(4)2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑反应,Na2O2中部分氧元素化合价由-1升高为0,部分化合价由-1降低为-2,所以Na2O2既作氧化剂又作还原剂;
(5)①湿法制备高铁酸钾,FeO42-为产物,Fe(OH)3为反应物,化合价升高总共3价,由电子转移守恒可知,ClO-为反应物,Cl-为生成物,化合价降低共2将,化合价升降最小公倍数为6,故Fe(OH)3的系数为2,FeO42-的系数为2,ClO-的系数为3,Cl-的系数为3,根据电荷守恒可知,OH-为反应物,系数为4,由元素守恒可知H2O为生成物,其系数为5,所以反应的离子反应方程式是2Fe(OH)3+3ClO—+ 4OH—=2FeO42-+3Cl-+5H2O;
②反应过程中氯元素化合价由+1降低为-1,Cl-是还原产物,若反应过程中转移了0.3mol电子,还原产物的物质的量为![]() 0.15mol。
0.15mol。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】乳酸(![]() ) 是乳酸菌在肠道通过代谢产生,是近年来研究的热点。
) 是乳酸菌在肠道通过代谢产生,是近年来研究的热点。
(1)乳酸可发生的化学反应类型有__________。
a.取代反应 b.加成反应 c.氧化反应 d.还原反应
(2)与乳酸含有相同官能团的同分异构体的结构简式_______________。
(3)相同物质的量的乳酸分别与足量的金属钠和氢氧化钠溶液反应,消耗的金属钠与氢氧化钠的物质的量之比是__________。
(4)两个乳酸分子在一定条件下发生酯化反应既能生成六元环状化合物M,又能得到链状化合物N,则M、N的结构简式分别是________,________。
(5)可降解一次性餐盒是由乳酸在一定条件下通过___________(填反应类型)生成的高分子材料制得,合成这种高分子材料的化学方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原是一类重要的反应。
(1)某同学写出以下三个化学方程式(未配平)
①N2O4+H2O→HNO3+HNO2 ②NO+HNO3→N2O3+H2O ③NH3+NO→HNO2+H2O
其中你认为一定不可能实现的是(填代号)____________;
(2)以下反应中H2O2仅体现还原性的是(填代号)____________,H2O2既体现氧化性又体现还原性的是(填代号)____________,从反应中判断H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是_______________;
A.H2O2+2Fe2++2H+=2Fe3++2H2O
B.2H2O2=2H2O+O2↑
C.Ag2O+H2O2=2Ag+O2↑+H2O
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
E.H2O2+MnSO4=MnO2+H2SO4
(3)用“双线桥法”标明以下反应中电子转移的方向和数目________,若反应中有3.01×1023个电子转移,则被氧化的还原剂的物质的量为___________。
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,不正确的是
A.将氧化镁与稀盐酸混合:MgO+2H+=Mg2++H2O
B.氢氧化钡溶液和稀硫酸溶液混合:Ba2++2OH-+2H++![]() =BaSO4↓+2H2O
=BaSO4↓+2H2O
C.将稀硫酸滴在铁片上:2Fe+6H+=2Fe3++3H2↑
D.将碳酸氢钠溶液与稀盐酸混合:HCO3-+H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上研究高效处理煤燃烧释放出来的SO2,有利于减小环境污染。在T℃时,利用CO处理SO2的反应为:2CO(g)+SO2(g)![]() 2CO2(g)+S(l) △H=akJ/mol;
2CO2(g)+S(l) △H=akJ/mol;
(1)已知T℃时:C(s)+![]() O2(g)=CO(g) △H1=-110.5kJ/mol
O2(g)=CO(g) △H1=-110.5kJ/mol
S(l)+O2(g)=SO2(g) △H2=-290.0kJ/mol
C(s)+O2(g)=CO2(g) △H3=-390.0kJ/mol
则T℃时,a=___。
(2)在T℃下,将1.4molCO和1molSO2通入2L恒容容器中发生上述反应,反应体系气体总物质的量随时间变化如图;在0~10min,反应的平均速率v(CO)=___,SO2的平衡转化率![]() (SO2)=___%;在T℃时该反应的平衡常数Kc=___L/mol。
(SO2)=___%;在T℃时该反应的平衡常数Kc=___L/mol。
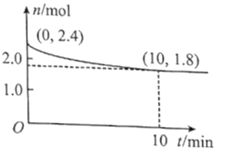
(3)实验测得:v正=v(CO)消耗=k正c(CO)c(SO2),v逆=v(CO2)消耗=k逆![]() ,k正、k逆为只受温度影响的速率常数。若将(2)中容器内的温度升高(假设各物质的状态不发生变化),
,k正、k逆为只受温度影响的速率常数。若将(2)中容器内的温度升高(假设各物质的状态不发生变化),![]() 的值将___(填“增大”、“减小”或“不变”)。
的值将___(填“增大”、“减小”或“不变”)。
(4)某科研团队研究用Fe2(SO4)3(aq)处理SO2:Fe3+溶液吸收SO2发生的离子反应方程式为___;其他外界条件不变下,在相同时间内温度对SO2吸收率的影响结果如图,在40℃前,SO2的吸收率随温度变化的可能原因是___;在40℃后,SO2的吸收率发生的变化是温度升高该反应逆向移动的结果,导致反应逆向移动的原因:一是该反应为放热反应,二是___。
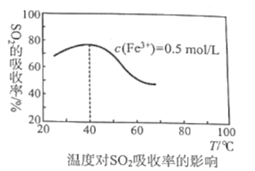
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g),CO在不同温度下的平衡转化率与压强及温度的关系如图所示。下列说法正确的是( )
CH3OH(g),CO在不同温度下的平衡转化率与压强及温度的关系如图所示。下列说法正确的是( )
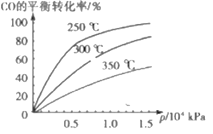
A.该反应的△H>0
B.实际生产选择的压强越高越好
C.使用合适的催化剂,可以降低反应的活化能,提高CO的转化率
D.平衡常数:K350℃<K250℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) ΔΗ=+QkJ/mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
Si(s)+4HCl(g) ΔΗ=+QkJ/mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C.反应至2min时,若HCl浓度为0.12mol/L,则H2的反应速率0.03mol/(L·min)
D.当反应吸收热量0.25QkJ时,生成的HCl通入含0.1mol NaOH的溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用废铁屑(主要成分为Fe2O3、Fe,少量碳)制取碳酸亚铁(FeCO3),设计了如图流程,根据流程图,下列说法不正确的是
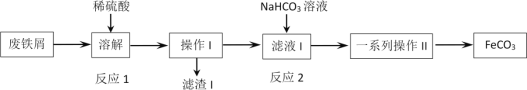
A.工业废铁屑往往附着有油脂,可通过热饱和碳酸钠溶液洗涤除去
B.反应2的离子方程式:Fe2++HCO3-=FeCO3↓+H+
C.操作I为过滤,洗涤操作,一系列操作II为蒸发浓缩,冷却结晶,过滤,洗涤
D.为避免硫酸溶解时Fe2+被空气氧化,废铁屑应适当过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:
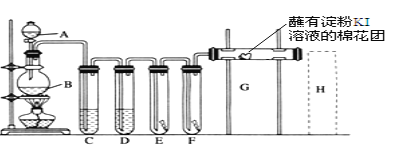
(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的化学方程式___________。
(2)D中放入浓H2SO4,其目的是________。
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是________,对比E和F中现象的差异可得出的结论及解释____________________________。
(4)G是浸有淀粉KI溶液的棉花球,G处现象是棉花球表面变成______,反应的离子方程式是______________,H是浸有NaBr溶液的棉花球,H处现象是棉花球表面变成______。
(5)画出H处尾气吸收装置图并注明试剂________。
(6)现在有一种名为“净水丸”的产品也能对饮用水进行快速的杀菌消毒,药丸通常分内外两层。外层的优氯浄Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去。亚硫酸钠将水中多余次氯酸除去的离子反应方程式为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com