
����Ŀ��������ԭ��һ����Ҫ�ķ�Ӧ��
��1��ijͬѧд������������ѧ����ʽ(δ��ƽ)
��N2O4��H2O��HNO3��HNO2 ��NO��HNO3��N2O3��H2O ��NH3��NO��HNO2��H2O
��������Ϊһ��������ʵ�ֵ��ǣ�����ţ�____________��
��2�����·�Ӧ��H2O2�����ֻ�ԭ�Ե��ǣ�����ţ�____________��H2O2�����������������ֻ�ԭ�Ե��ǣ�����ţ�____________���ӷ�Ӧ���ж�H2O2��Ag2O��K2CrO4��������ǿ������˳����_______________��
A��H2O2+2Fe2++2H+=2Fe3++2H2O
B��2H2O2=2H2O+O2��
C��Ag2O+H2O2=2Ag+O2��+H2O
D��3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
E��H2O2+MnSO4=MnO2+H2SO4
��3������˫���ŷ����������·�Ӧ�е���ת�Ƶķ������Ŀ________������Ӧ����3.01��1023������ת�ƣ��������Ļ�ԭ�������ʵ���Ϊ___________��
2KMnO4��16HCl��Ũ��=2KCl��2MnCl2��5Cl2����8H2O
���𰸡� �� C B Ag2O��H2O2��K2CrO4 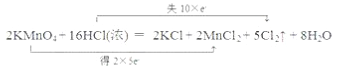 0.5mol
0.5mol
����������1������N2O4��NԪ�صĻ��ϼ������ߺͽ��ͣ������绯��Ӧ������ʵ�֣����е�NO�е�NԪ�صĻ��ϼ����ߣ�HNO3��NԪ�صĻ��ϼ۽��ͣ����ڹ��з�Ӧ������ʵ�֣�����NH3��NO��NԪ�صĻ��ϼ۶������ߣ�û�л��ϼ۽��͵�Ԫ�أ�������ʵ�֣��ʴ�Ϊ����
��2��A��H2O2��OԪ�صĻ��ϼ�ȫ��������ֻ����������ֻ���������ԣ������Դ�С��H2O2>Fe3+��B��H2O2��OԪ�صĻ��ϼۼ������ֽ��ͣ��ʼ������������ǻ�ԭ�������ֳ������Ժͻ�ԭ�ԣ�C��H2O2��OԪ�صĻ��ϼ�ȫ�����ߣ�ֻ����ԭ����ֻ���ֳ���ԭ�ԣ�Ag2O�������������������Դ�СΪAg2O��H2O2��D��H2O2��OԪ�صĻ��ϼ�ȫ�����ͣ�����������K2CrO4Ϊ����������������Դ�СΪH2O2��K2CrO4��E��H2O2��OԪ�صĻ��ϼ�û�б仯����û��������Ҳû�л�ԭ�ԡ����Ͽ�֪��H2O2�����ֻ�ԭ�Ե��Ƿ�ӦC��H2O2�����������������ֻ�ԭ�Ե��Ƿ�ӦB��H2O2��Ag2O��K2CrO4��������ǿ������˳����Ag2O��H2O2��K2CrO4
��3���÷�Ӧ��һ��������ԭ��Ӧ����˫���ű�ʾ���£�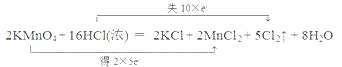 ��3.01��1023�����ӵ����ʵ���Ϊ0.5mol����ԭ��ΪHCl������ΪCl2��1molHCl����ԭ��ʧȥ1mol���ӣ�������ԭ����HCl��0.5mol��
��3.01��1023�����ӵ����ʵ���Ϊ0.5mol����ԭ��ΪHCl������ΪCl2��1molHCl����ԭ��ʧȥ1mol���ӣ�������ԭ����HCl��0.5mol��


 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д� ��ĩ�����ϵ�д�
��ĩ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л����������ȥ��һ�������ǻ���ʣ��ṹ��Ϊ�������硰��SO2������Ϊ������������SOCl2��SO2Cl2��COCl2�ֱ��Ϊ�������ȡ������Ⱥ�̼���ȣ����Ƕ��кܶ����Ƶ����ʣ��綼�ܷ���ˮ�ⷴӦ���ɶ�Ӧ���ᡢ�������Ȼ����ȡ��ش��������⣺
��1����֪��SO2(g)+PCl5(s) ![]() SOCl2(l)+POCl3(l) ��H1=a kJ��mol1
SOCl2(l)+POCl3(l) ��H1=a kJ��mol1
PCl5(s)+H2O(l) ![]() POCl3(l)+2HCl(g) ��H2=b kJ��mol1
POCl3(l)+2HCl(g) ��H2=b kJ��mol1
��ӦSOCl2(l)+H2O(l) ![]() SO2(g)+2HCl(g) ��H3=________kJ��mol1���ú�a��b�Ĵ���ʽ��ʾ����
SO2(g)+2HCl(g) ��H3=________kJ��mol1���ú�a��b�Ĵ���ʽ��ʾ����

��2����1 L���ܱ������г���1 mol SO2��2 mol Cl2��������Ӧ��SO2(g)+Cl2(g)![]() SO2Cl2(l)����ƽ��������������䣬��Сѹǿ������ͼ�л����ı�������Ӧ������ʱ��ı仯����ͼ���ٴδ�ƽ�����SO2��ת����Ϊ35%����Ӧ�����ܱ�������ע��������BaCl2��Һ���������ɳ���������Ϊ___________g��
SO2Cl2(l)����ƽ��������������䣬��Сѹǿ������ͼ�л����ı�������Ӧ������ʱ��ı仯����ͼ���ٴδ�ƽ�����SO2��ת����Ϊ35%����Ӧ�����ܱ�������ע��������BaCl2��Һ���������ɳ���������Ϊ___________g��
��3��һ�������´��ڷ�Ӧ��CO(g)+Cl2(g) ![]() COCl2(g) ��H=108 kJ��mol1������3�������Ϊ10 L���ܱ���������������������ͼ��ʾͶ�ϣ�����150�������¿�ʼ��Ӧ��ƽ�⡣
COCl2(g) ��H=108 kJ��mol1������3�������Ϊ10 L���ܱ���������������������ͼ��ʾͶ�ϣ�����150�������¿�ʼ��Ӧ��ƽ�⡣
1 mol CO��1 mol Cl2 |
�����Ⱥ���
1 mol COCl2 |
�����º���
1 mol CO��1 mol Cl2 |
�����º���
����������CO��ת��������������COCl2��ת����֮��_________�������������������1�����������з�Ӧǰ��ѹǿΪ1 atm����Ӧ�����ѹǿΪ0.75 atm����Ӧ��ƽ�ⳣ��Kp=__________����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ����ѹ�����ʵ�������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ����
A. 25��ʱ��pH=4.5��������Һ��c(H+)��pH=5.5��������c(H+)��10��
B. ��Ϊ�Ͻ��ڳ�ʪ�Ŀ��������γ�ԭ��أ����ԺϽ����ʴ�Զ��ϲ�
C. һ�������£�ʹ�ô����ܼӿ췴Ӧ���ʲ���߷�Ӧ���ƽ��ת����
D. �����£�2NO(g)+O2(g)![]() 2NO2(g)�ܹ��Է����У���÷�Ӧ�ġ�H<0
2NO2(g)�ܹ��Է����У���÷�Ӧ�ġ�H<0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�ɢϵ�ܲ����������ЧӦ�����ǣ� ��
A.����ͭ��ҺB.��ˮC.��ȪˮD.Fe(OH)3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������ˮ��Һ�У�ֻ���ܺ������������е������֣�K+��Ca2+��Fe3+��NH4+��Cl-��CO32- ��SO42-����ÿ��ȡ100mL��Һ����ʵ�飺����֪��NH4++OH - = NH3�� +H2O ��
�ٵ�һ�ݼ���AgNO3��Һ�г���������
�ڵڶ��ݼ�������NaOH����ȣ��ռ�������0.896 L����״���£�
�۵����ݼ�������BaCl2��Һ��ø������6.27g����������������ϴ�ӣ������ʣ��2.33g��
��ش�
��1��c(CO32-) =_____________mol/L��
��2��K+ �Ƿ����____________�������ڣ�Ũ�ȷ�Χ��__________________(�������ڣ��ػش�)��
��3����������ʵ�飬�����ж��Ƿ���ڵ�������____________�������ӷ��ţ��������ڴ����ӣ����������鲽��__________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������⡿�����µ����[Ca(IO3)2]��һ�ְ�ɫ���壬����ˮ���������Ҵ������������ᣬ��Ŀǰ�㷺ʹ�õļ��ܲ������ܲ��Ƶ�����ʳƷ�ʹ������Ӽ������Ʊ�ԭ�����£�

��.����Ƶ��Ʊ�
(1)ijͬѧ��Ƶ�ʵ��װ������ͼ��ʾ(�г�װ����ʡ��)������ڵļ��ȷ�ʽΪ_________��
(2)�������ȴ�ȵı�����Һû���������壬Ϊ�˵õ�������Բ�ȡ��һ�ִ�ʩ��________��
(3)�����ϴ�ӵľ��������____________��

��.��Ʒ���Ȳⶨ
ȷ��ȡ0.5000 g��Ʒ���ữ�ܽ⣬������250 mL,����ȡ��25.00 mL��������ƿ�У�����������KI��ַ�Ӧ����0.04000 mol��L-1�����������Һ�ζ����յ㣬�ظ����ϲ��裬�����ʵ���������£�
1 | 2 | 3 | |
�ζ���ʼ����/mL | 1.52 | 1.16 | 0.84 |
�ζ���ֹ����/mL | 31.50 | 31.18 | 30.84 |
��֪��2Na2S2O3 + I2= Na2S4O6 + 2NaI
(4)����KIʱ������Ӧ�����ӷ���ʽ��_____________��
(5)�ζ�ʱ���õ�ָʾ����_________________.
(6)�������Ʒ�Ĵ���Ϊ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ƽ
��1��C+H2SO4 (Ũ��![]() CO2��+SO2��+H2O��__________��
CO2��+SO2��+H2O��__________��
��2��S2O32- +Cl2+H2O=SO42- +Cl-+H+��__________��
��3��FeSO4![]() Fe3O4+SO2��+SO3����__________��
Fe3O4+SO2��+SO3����__________��
��4��FeO +HNO3=Fe��NO3)3��+NO��+H2O��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�ҩѧ������������ֲ��ƻ���Ҷ�к�ƶ��ű�������ʡ��������ض��ٻ�2015��ŵ����������ѧ�Ҷ������صĽṹ���н�һ���������ϳ�ҩЧ���ѵ�˫�������ء�����ѡ�

����˵���������
A. ���ûƻ���Ҷ�о������ؽṹ�Ļ�������Ϊ�����롢�ᴿ��Ԫ�ط���ȷ��ʵ��ʽ���ⶨ��Է�������ȷ������ʽ��������ȷ���ṹʽ
B. �١��ڵķ�Ӧ���ͷքeΪ��ԭ��Ӧ��ȡ����Ӧ
C. ˫����������ˮ�е��ܽ��Դ���������
D. ��������ȷ�������к��к��ֹ����ŵ���Ϣ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com