
【题目】CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g),CO在不同温度下的平衡转化率与压强及温度的关系如图所示。下列说法正确的是( )
CH3OH(g),CO在不同温度下的平衡转化率与压强及温度的关系如图所示。下列说法正确的是( )
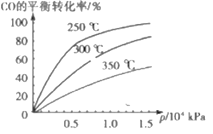
A.该反应的△H>0
B.实际生产选择的压强越高越好
C.使用合适的催化剂,可以降低反应的活化能,提高CO的转化率
D.平衡常数:K350℃<K250℃
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Al2O3样品中含有一定量的Cu、Fe、Fe2O3杂质。现通过下列生产过程,从该样品中回收铁红。流程如下:

(1)操作a是________,在实验室进行该操作需要的玻璃仪器有烧杯、漏斗和_______。
(2)试剂①是_______,固体II是_________(填化学式)。
(3)红褐色沉淀的成分是_________;写出白色沉淀转化为红褐色沉淀的化学方程式:______________。
(4)溶液II中铁元素的存在形式是_______(填离子符号),如何用实验证明:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了防止钢铁零件生锈,常采用化学处理使钢铁零件表面生成Fe3O4的致密保护层——“发蓝”。化学处理过程中其中一步的反应为3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑。下列叙述不正确是
A.上述反应涉及到的物质中,Fe的还原性最强
B.上述反应涉及到的物质中,NaNO2的氧化性最强
C.上述反应中,铁是还原剂,NaNO2和NaOH是氧化剂
D.![]() 的氧化性大于
的氧化性大于![]() 的氧化性
的氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
Ⅰ.(1)所含铁元素既有氧化性又有还原性的物质是________(填字母)。
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合的能力,药品美蓝是其有效的解毒剂,下列说法中正确的是(_______)
A. NaNO2被氧化 B. 药品美蓝是还原剂
C. NaNO2是还原剂 D. 药品美蓝被还原
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:________________________________。
Ⅱ. 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(4)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中Na2O2是________(填“氧化剂”或“还原剂”)。
(5)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、![]() 、Cl-、H2O。
、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3∶2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:__________________________________________。
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.01molL-1KAl(SO4)2溶液中的SO42-数目为0.02NA
B.用浓盐酸分别与MnO2、KClO3反应制备1mol氯气,转移的电子数均为2NA
C.1molNH4NO3完全溶于稀氨水中,溶液呈中性,溶液中NH4+的数目为NA
D.9.0g葡萄糖和蔗糖的混合物中含碳原子的数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为研究Cl2的性质,设计如图所示装置进行实验。装置III中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
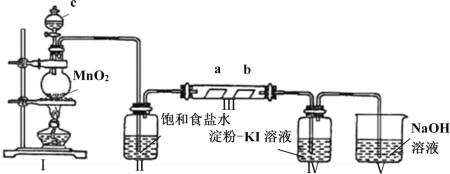
(1)装置Ⅰ中仪器c的名称是_______________,实验室以二氧化锰和浓盐酸制备氯气的离子方程式为_______________________________________________________。
(2)装置Ⅱ的作用是________________________。
(3)实验过程中装置Ⅳ中的实验现象为______________________________。
(4)实验结束后,该组同学在装置III中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在上图装置Ⅱ与III之间添加下图中的_______装置(填序号)。

(5)装置Ⅴ的目的是防止尾气污染空气,写出装置Ⅴ中发生反应的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如图所示,下列说法正确的是
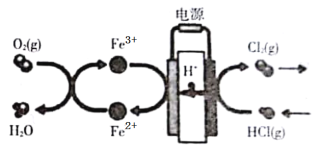
A.负极区发生的反应有Fe3++e-= Fe2+,4Fe2++O2+4H+=4Fe3++2H2O
B.Fe2+在过程中起催化剂作用
C.阳极材料可选用Ag
D.电路中转移1 mol电子时,消耗氧气5.6L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com