
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
【答案】Al2O3 FeCl2 用磁铁靠近粉末状混合物,将铁粉吸附在磁铁表面 C 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】
I为红褐色沉淀判断为Fe(OH)3,加热反应生成J为Fe2O3,H在空气中氧化为氢氧化铁推断H为Fe(OH)2,B+HCl=G,推断G为FeCl2,B为Fe,含A、B两种金属单质的粉末状混合物中B为Fe,A能和氢氧化钠反应、盐酸反应说明为Al,所以C为NaAlO2,D为AlCl3,依据E为白色沉淀Al(OH)3,则X为制备氢氧化铝的反应最好选择氨水,则X为NH3H2O,F为Al2O3,依据推断物质分析回答问题。
(1)依据判断F、G的化学式为:F为Al2O3,G为FeCl2;
(2)混合物中两种金属分离开的最简单的方法是利用铁可以被磁铁吸引,方法为:用磁铁靠近粉末状混合物,将铁粉吸附在磁铁表面;
(3)D→E的转化中是X和氯化铝反应生成氢氧化铝的反应,依据实验室制取氢氧化铝的方法和氢氧化铝的性质分析,氢氧化铝能溶于过量强碱溶液中,所以加入过量的X可能是氨水,故答案为:C;
(4)A→C是Al和氢氧化钠反应生成偏铝酸钠和氢气,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;H→I是氢氧化亚铁被氧化为氢氧化铁,该反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。


科目:高中化学 来源: 题型:
【题目】实验室可由![]() 、
、![]() 、
、![]() 为原料制备
为原料制备![]() ,若反应后废液中的
,若反应后废液中的![]() 排入水中,则过量的氮元素会使水体富营养化。此外考虑到其他污染源,污水一般还会含有
排入水中,则过量的氮元素会使水体富营养化。此外考虑到其他污染源,污水一般还会含有![]() 、
、![]() 、
、![]() 等。
等。
(1)已知![]() 化学式可表示为
化学式可表示为![]() ,由常温下逐渐升温的过程中会发生分解。已知起始状态到A点是失去了部分结晶水,B点对应的物质是钒的氧化物,如下图所示。
,由常温下逐渐升温的过程中会发生分解。已知起始状态到A点是失去了部分结晶水,B点对应的物质是钒的氧化物,如下图所示。
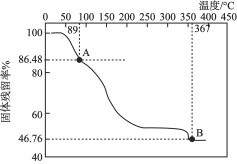
①写出起始状态到A点发生分解反应的化学方程式:________________。
②B点对应物质的化学式是______________。
(2)废水中![]() 和
和![]() 的处理。通过形成铁炭(铁和活性炭)原电池可对废水中的有机物及含氮物质等进行处理,将酸性废水中以
的处理。通过形成铁炭(铁和活性炭)原电池可对废水中的有机物及含氮物质等进行处理,将酸性废水中以![]() 和
和![]() 形式存在的氮元素转化为
形式存在的氮元素转化为![]() 除去。
除去。
①写出![]() 在正极发生的电极反应式______________。
在正极发生的电极反应式______________。
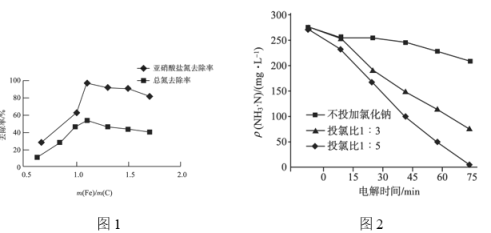
②不同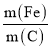 的脱氮效果如图1所示,则合适的
的脱氮效果如图1所示,则合适的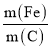 =________。
=________。
③实验测得当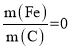 时,对废水中的氮也有一定的脱除率,其原因为________。
时,对废水中的氮也有一定的脱除率,其原因为________。
(3)废水中![]() 的处理。用电解法可对废水进行脱氮处理。
的处理。用电解法可对废水进行脱氮处理。
①电解时含氯离子转化为次氯酸,![]() 与
与![]() 反应生成
反应生成![]() ,当生成
,当生成![]() 时,转移的电子数为________mol。
时,转移的电子数为________mol。
②氯离子含量对废水脱氮效果的影响如图2所示,投氯比是指氨氮与氯离子物质的量的比,三种情况下投料为![]() 时脱氮效果________(填“最好”“最差”或“居中”),原因可能是________。
时脱氮效果________(填“最好”“最差”或“居中”),原因可能是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象能得到相应结论的是
选项 | 实验操作和现象 | 结 论 |
A | 向苯酚钠溶液中通入足量CO2溶液变浑浊 | 酸性:H2CO3>C6H5OH>HCO3- |
B | 向KBrO3溶液中通入少量Cl2然后再加入少量苯,有机层呈橙红色 | 氧化性:Cl2>Br2 |
C | 将等浓度等体积的KI溶液和FeCl3溶液混合,充分反应后滴入KSCN溶液,溶液变红 | 溶液中存在平衡: 2Fe3++2I- |
D | 向2支均盛有2mL相同浓度银氨溶液的试管中,分别滴入2滴相同浓度的KCl、KI溶液,前者无明显现象,后者有黄色沉淀 | Ksp(Agl)>Ksp(AgCl) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钕铁硼磁铁是目前为止具有最强磁力的永久磁铁。预计在未来20年里,不可能有替代钕铁硼磁铁的磁性材料出现。生产钕铁硼磁铁的主要原材料有稀土金属钕、纯铁、铝、硼以及其它稀土原料。
(1)钕(Nd)为60号元素,在元素周期表中的位置是___;
(2)实验测得气态A1C13的实际存在形式为A12C16双聚分子,其中A1原子的杂化方式是___;A12C16与过量NaOH溶液反应生成Na[Al(OH)4];[A1(OH)4]-中存在的化学键有___。
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
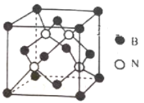
(3)已知立方BN晶体晶胞结构如图所示,设晶胞中最近的B、N原子之间的距离为a nm,晶体的密度为b gcm-3,则阿伏加德罗常数为____mol-1 (列式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:

请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有______(填离子符号)。
(2)操作②中反应的离子方程式:__________________________________。
(3)操作③中反应的离子方程式:__________________________________。
(4)操作④中一系列处理的操作步骤:过滤、______、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______g。(用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A.钠与水的反应: Na+2H2O =Na++2OH-+H2↑
B.氯化铵固体与熟石灰共热制氨气:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
C.氯气通入石灰乳中制漂白粉:Cl2+2OH-=Cl-+ClO-+H2O
D.食醋除水垢:CaCO3+ 2CH3COOH = Ca2+ + 2CH3COO- + CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+![]() O2 (g)→2CO2 (g)+H2O(l) △H =-1300kJ/mol 的说法中,正确的是( )
O2 (g)→2CO2 (g)+H2O(l) △H =-1300kJ/mol 的说法中,正确的是( )
A.当1 NA个水分子生成且为液体时,吸收1300kJ的能量
B.当10 NA个电子转移时,该反应放出1300kJ的能量
C.当2 NA个碳氧共用电子对生成时,放出1300kJ的能量
D.当4 NA个碳氧共用电子对生成时,放出1300kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度T1和T2时,分别将0.5molCH4和1.2molNO2充入体积为1L的密闭容器中,发生反应: CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),测得有关数据如表:
N2(g)+CO2(g)+2H2O(g),测得有关数据如表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法正确的是
A.T1时0~10minNO2的平均反应速率为0.15mol·L-1·min-1
B.T2时CH4的平衡转化率为70.0%
C.保持其他条件不变,T1时向平衡体系中再充入0.3molCH4和0.80molH2O(g),平衡向正反应方向移动
D.保持其他条件不变,T1时向平衡体系中再充入0.5molCH4和1.2molNO2,与原平衡相比,达新平衡时N2的浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能正确表示下列变化的离子方程式的是
A.MnO2与浓盐酸加热:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B.FeCl2溶液在空气中变质:12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓
C.NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO32-
D.R-NH2电离:R-NH2+H2O![]() R-NH3++OH-
R-NH3++OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com