
����Ŀ����������������������Ʒ��������̨������Ȧ����ʽ���У� ����ƿ ����ʽ�ζ��ܺͼ�ʽ�ζ��� ���ձ� �ݲ����� ��ͷ�ι� ����ƽ�������룩 ����ֽ ����Ͳ �����©����
��������ҩƷ����A��NaOH���� ��B����NaOH��Һ��C��δ֪Ũ������ ��D������ˮ��E��̼������Һ
������������ѧ��ʵ�飬�ش��������⣺
��1������ʱ��Ӧѡ�õ�����������_________________________�����ţ���
��2������һ�����ʵ���Ũ�ȵ�NaOH��Һʱ����ȱ�ٵ�������__________��
��3��������к͵ζ�ʱ����ȱ�����Լ���____________________��
��4�������к͵ζ�ʱ���������ý�Ҫʢ����Һ������ϴ�����������е�______�����ţ����ף���ʽ�ζ��� �ң���ʽ�ζ��� ������ƿ
��5���ñ���NaOH��Һ�ζ�δ֪Ũ�ȵ����ᣬѡ�÷�̪��Ϊָʾ������ɲⶨ���ƫ�ߵ�ԭ�������______________��
A�����Ʊ���Һ��NaOH�л���Na2CO3����
B���ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�����������ȷ
C��ʢװδ֪Һ����ƿ������ˮϴ����δ��δ֪Һ��ϴ
D���ζ�ǰ�����ݣ��ζ���������ʧ��
II. �״���CH3OH����һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��ӦI��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H1
CH3OH(g)+H2O(g) ��H1
��ӦII��CO(g)+2H2(g)![]() CH3OH(g) ��H2
CH3OH(g) ��H2
�ٷ�ӦI��ƽ�ⳣ������ʽΪK=________________________
���±����������Ƿ�Ӧ���ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ��(K)
�¶� | 250�� | 300�� | 350�� |
K | 2.041 | 0.270 | 0.012 |
�ɱ��������ж���H2______0����S______0 (��������������������������)��
��ij�¶��£���2 mol CO��6 mol H2����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c(CO)=0.2 mol��L-1����CO��ת����Ϊ________��
��2����֪�ڳ��³�ѹ�£�ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ�����������ͼ��ʾ�ĵ��װ�ã�

��2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ��H ��-1275.6 kJ��mol-1
��H2O(g)��H2O(l) ��H ��-44.0 kJ��mol-1
��д����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽ____________________��
��д����ͼ���װ���и�����Ӧʽ��________________________________��
���𰸡��٢ݢ�� ����ƿ ���ָʾ��(��̪��Һ�����) �� AD ![]() �� �� 80�� CH3OH(l)+
�� �� 80�� CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)��H=-725.8kJ�Mmol CH3OH-6e-+8OH-=CO32-+6H2O
O2(g)=CO2(g)+2H2O(l)��H=-725.8kJ�Mmol CH3OH-6e-+8OH-=CO32-+6H2O
��������
��(1)�����ǽ����岻�����Һ������һ�ַ�������װ��������̨���ձ�����������©������������ֽ��ɣ�
(2)�������Ʋ����Ǽ��㡢�������ܽ⡢ϴ�ӡ����ݡ�ҡ�ȡ�װƿ��������Ҫ��������
(3)��������к͵ζ�����Ҫ���Լ���������
(4)�к͵ζ���Ҫ�õ���ʽ�ζ��ܡ���ʽ�ζ��ܺ���ƿ�����ʵ���ע����������жϣ�
(5)����c(��)=![]() �����ζ������в�����������ҺŨ�ȱ������ı�Һ���ƫС���ζ����ƫ�ͣ�����ƫ�ߣ��ݴ˽��н��
�����ζ������в�����������ҺŨ�ȱ������ı�Һ���ƫС���ζ����ƫ�ͣ�����ƫ�ߣ��ݴ˽��н��
II. (1)������ƽ�ⳣ��K=![]() ��д�����ɱ������ݣ�ƽ�ⳣ�����¶�����С��˵�������¶ȣ�ƽ�������ƶ�����Ϸ���ʽ������𣻢۴ﵽƽ����c(CO)=0.2molL-1�����Լ���ƽ��ʱCO�����ʵ������Ӷ������Ӧ��CO�����ʵ������ټ���CO��ת���ʣ�
��д�����ɱ������ݣ�ƽ�ⳣ�����¶�����С��˵�������¶ȣ�ƽ�������ƶ�����Ϸ���ʽ������𣻢۴ﵽƽ����c(CO)=0.2molL-1�����Լ���ƽ��ʱCO�����ʵ������Ӷ������Ӧ��CO�����ʵ������ټ���CO��ת���ʣ�
(2)�����ݸ�˹���ɼ��㣻�ڸ�ȼ�ϵ���У�ͨ��״��ĵ缫�Ǹ�����ͨ�������ĵ缫����������������������Ӧ���ݴ���д�缫��Ӧʽ��
��(1)�����ǽ����岻�����Һ������һ�ַ�������װ��������̨���ձ�����������©������������ֽ��ɣ���Ϊ�٢ݢ�⣬�ʴ�Ϊ���٢ݢ�⣻
(2)����һ�����ʵ���Ũ�ȵ�NaOH��Һ�IJ��������м��㡢�������ܽ⡢��Һ��ϴ����Һ�����ݡ�ҡ�ȵȲ�����һ����������ƽ��������ҩ��ȡ��ҩƷ�����ձ����ܽ�(������Ͳ��ȡˮ�����ձ�)�����ò��������裬�����ܽ⣬��ȴ��ת�Ƶ�����ƿ�У����ò�����������ϴ���ձ���������2��3�Σ�����ϴ��Һ��������ƿ�У���ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ�����ݵߵ�ҡ�ȣ���������������������ƽ���ձ���������������ƿ����ͷ�ιܣ��ʻ�ȱ������ƿ���ʴ�Ϊ������ƿ��
(3)������к͵ζ��Ĺ����У���Ҫ���Լ�����Һ����Һ�����ָʾ�����ʻ���Ҫ�������ָʾ��(��̪��Һ�����)���ʴ�Ϊ�����ָʾ��(��̪��Һ�����)��
(4)�к͵ζ���Ҫ�õ���ʽ�ζ��ܡ���ʽ�ζ��ܺ���ƿ��������ʽ�ζ��ܡ���ʽ�ζ�����Ҫ��ϴ����ƿ������ϴ��������ƫ�ߣ��ʴ�Ϊ������
(5)A�����Ʊ���Һ��NaOH�л���Na2CO3���ʣ��Է�̪Ϊָʾ��ʱ�����������������ƺ�Na2CO3���ĵ���ǰ�ߴ����Ա���Һ�����������л���Na2CO3����ʱ���V(��)ƫ����c(��)=![]() ����֪c(��)ƫ�ߣ���A��ȷ��B���ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�������������ȷ�����±�Һ���������ƫС����ⶨ���ƫ�ͣ���B����C��ʢװδ֪Һ����ƿ������ˮϴ����δ�ô���Һ��ϴ��������ȷ������Ӱ��ⶨ�������C����D���ζ�ǰ�����ݣ��ζ���������ʧ���������ı�Һ���ƫ�ⶨ���ƫ�ߣ���D��ȷ���ʴ�Ϊ��AD��
����֪c(��)ƫ�ߣ���A��ȷ��B���ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�������������ȷ�����±�Һ���������ƫС����ⶨ���ƫ�ͣ���B����C��ʢװδ֪Һ����ƿ������ˮϴ����δ�ô���Һ��ϴ��������ȷ������Ӱ��ⶨ�������C����D���ζ�ǰ�����ݣ��ζ���������ʧ���������ı�Һ���ƫ�ⶨ���ƫ�ߣ���D��ȷ���ʴ�Ϊ��AD��
II. (1)�ٷ�ӦI��CO2(g)+3H2(g)CH3OH(g)+H2O(g)����Ӧ��ƽ�ⳣ��K=![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
���ɱ������ݣ�ƽ�ⳣ�����¶�����С��˵�������¶ȣ�ƽ�������ƶ�������ӦΪ���ȷ�Ӧ����H2��0����Ӧǰ�����������С���ؼ�С�ķ�Ӧ����S��0���ʴ�Ϊ����������
��ij�¶��£���2molCO��6molH2����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c(CO)=0.2molL-1��ƽ��ʱCO�����ʵ���=0.2molL-1 ��2L=0.4mol����Ӧ��COΪ2mol-0.4mol=1.6mol����CO��ת����=![]() ��100%=80%���ʴ�Ϊ��80%��
��100%=80%���ʴ�Ϊ��80%��
(2)�١���2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)��H=-1275.6 kJ�Mmol����H2O(g)=H2O(l)��H=-44.0 kJ�Mmol�����ݸ�˹���ɼ��㣬�ɸ�˹���ɣ���+����4�ã�2CH3OH(l)+3O2(g)= 2CO2(g)+4H2O(l)������H=-1275.6kJ�Mmol+(-44.0kJ/mol)��4=-1451.6kJ�Mmol�����Լ״�ȼ���ȵ��Ȼ�ѧ��Ӧ����ʽΪ��CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)��H=-725.8kJ�Mmol���ʴ�Ϊ��CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)��H=-725.8kJ�Mmol���ʴ�Ϊ��CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)��H=-725.8kJ�Mmol��
O2(g)=CO2(g)+2H2O(l)��H=-725.8kJ�Mmol��
�ڸ�ȼ�ϵ���У�ͨ��״��ĵ缫�Ǹ�����ͨ�������ĵ缫��������������ӦʽΪCH3OH-6e-+8OH-=CO32-+6H2O��������ӦʽΪO2+4e-+2H2O=4OH-���ʴ�Ϊ��CH3OH-6e-+8OH-=CO32-+6H2O��


 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(C3H8)������ȼ�ϵ�غ�п���ؾ�Ϊ��;�㷺��ֱ����Դ���ŵ�ʱ���ߵ��ܷ�Ӧ�ֱ�ΪC3H8+5O2=3CO2+4H2O��2Zn+O2=2ZnO���ñ���(C3H8)ȼ�ϵ��Ϊп���س���װ����ͼ��ʾ������˵������ȷ����

A. ����MΪCO2
B. ȼ�ϵ������1mo1 O2ʱ����������4 mol OH-��bĤ��P�缫�ƶ�
C. aĤ��bĤ������ѡ�������ӽ���Ĥ
D. ��װ���У�п���صĸ�����ӦʽΪZn+2OH--2e-=ZnO+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������н������·�Ӧ��I2(g)+H2(g)![]() 2HI(g)����֪I2��H2��HI����ʼŨ�ȷֱ�Ϊ0.1molL-1 ��0.3molL-1��0.2molL-1��һ�������µ���Ӧ�ﵽƽ��ʱ�������ʵ�Ũ���п�����
2HI(g)����֪I2��H2��HI����ʼŨ�ȷֱ�Ϊ0.1molL-1 ��0.3molL-1��0.2molL-1��һ�������µ���Ӧ�ﵽƽ��ʱ�������ʵ�Ũ���п�����
A.H2Ϊ0.15molL-1B.HIΪ0.35molL-1
C.I2Ϊ0.2molL-1D.HIΪ0.4molL-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ���У��׳ص��ܷ�ӦʽΪ2CH3OH+ 3O2+ 4KOH=2K2CO3+ 6H2O���Իش�:
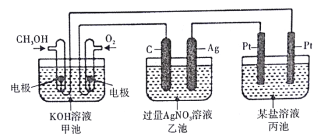
(1)ͼ�м׳ص�װ����_________������ԭ���������������)���ҳ���ʯī�缫��________����
(2)д��ͨ��CH3OH�ĵ缫�ĵ缫��Ӧʽ��________________
(3)�ҳ����ܷ�Ӧ�Ļ�ѧ����ʽΪ___________________
(4)���ҳ���Ag������������5.40gʱ���׳�������������O2________mL����״��������ʱ����ij�缫������1.60gij������������е�����Һ������________������ĸ��
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ������ȷ����
A.��Ӧ��������������������������ʱ���÷�Ӧһ�����ܷ���
B.ǿ���ǿ�Ӧ�ų�������һ�����к���
C.��ʯī�Ƚ��ʯ�ȶ���֪��C(���ʯ��s)===C(ʯī��s) ��H<0
D.��101 kPa��25��ʱ��2 g H2��ȫȼ������Һ̬ˮ���ų�285.8 kJ���������ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ�ɱ�ʾΪ�� 2 H2(g)��O2(g)===2 H2O(l) ��H����571.6 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������⣬����������⡣
��1�������£���1 mL pH��1��H2SO4��Һ��ˮϡ�͵�100 mL��ϡ�ͺ����ҺpH��_____��
��2��ij�¶�ʱ�����0.01 mol��L��1��NaOH��Һ��pHΪ11������¶���ˮ�����ӻ�����Kw��______�����¶�__________25��(������������������������������)��
��3�������£���pH��5��H2SO4����Һ����ˮ�������H+Ũ��Ϊc1��pH��9��Ba(OH)2��Һ����ˮ�������H+Ũ��Ϊc2����c1/ c2��__________��
��4�������£�pH��13��Ba(OH)2��ҺaL��pH��3��H2SO4��ҺbL���(��Ϻ���Һ����仯���Բ���)��
�����û����Һ�����ԣ���a��b��__________�������û����ҺpH��12����a��b��__________��
��5����������Һ������Ba(OH)2��Һ����������Ӹպó�����ȫʱ����Һ��pH______7(��>��<��=)�����ӷ�Ӧ�ܷ���ʽΪ______________________��
��6����ʵ��ȷ��ij��HA��������ʡ���ͬѧ�ķ����ǣ�
�ף�a.��ȡһ��������HA���Ƴ�0.1molL��1����Һ100mL��
b.��pH��ֽ�������Һ��pH������֤��HA��������ʡ�
�ң�a.����֪���ʵ���Ũ�ȵ�HA��Һ�����ᣬ�ֱ�����pH��1����������Һ�� 100mL��
b.�ֱ�ȡ��������Һ��10mL����ˮϡ��Ϊ100mL��
c.��ȡ��ͬ���������ϡ��Һװ�������Թ��У�ͬʱ���봿����ͬ��п�����۲췴Ӧ������֤��HA��������ʡ�
�������������ĵڢٲ��У���Ҫ�õ��Ķ���������_______��
�ڼ����У�˵��HA��������ʵ������Dz����Һ��pH____1(ѡ������������������������)��
�ҷ����У�˵��HA��������ʵ�������_______(��ѡ�۷�)��
A.װHCl��Һ���Թ��зų�H2�����ʿ�
B.װHA��Һ���Թ��зų�H2�����ʿ�
C.�����Թ����������������һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����ķ���COx��NOx��SOx�Ի����к������ܺ������������գ����Լ�����Ⱦ�����Ϊ����
(1)��֪�����ȼ����Ϊ890 kJ/mol��1 molˮ�������Һ̬ˮ����44 kJ��N2��O2��Ӧ����NO�Ĺ������£�
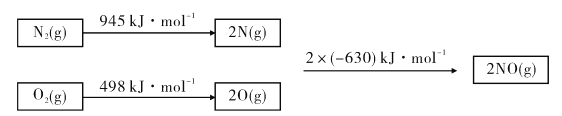
��CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ��H=_______.
(2)����β���к���CO��NO��ij�о�С�����÷�Ӧ��2CO(g)+2NO(g) ![]() N2 (g)+2CO2 (g)ʵ������������ŷš�T1��ʱ���ں��ݵ��ܱ�������ͨ��һ������CO��NO�����Է�����������Ӧ����ò�ͬʱ���NO��CO��Ũ�����±���
N2 (g)+2CO2 (g)ʵ������������ŷš�T1��ʱ���ں��ݵ��ܱ�������ͨ��һ������CO��NO�����Է�����������Ӧ����ò�ͬʱ���NO��CO��Ũ�����±���
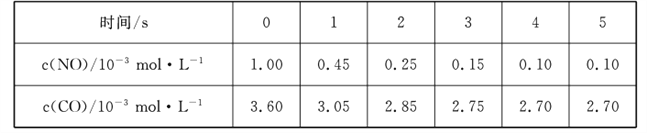
��0��2 s����N2��ʾ�Ļ�ѧ��Ӧ����Ϊ____�����¶��£���Ӧ��ƽ�ⳣ��K1_____��
�����÷�Ӧ�ھ��Ⱥ��������½��У���Ӧ�ﵽƽ�����ϵ���¶�ΪT2�棬��ʱ�Ļ�ѧƽ�ⳣ��ΪK2����K1____K2���>������<����=������ԭ����________
(3)��ס��������ݻ���Ϊ1 L�ĺ��º��ݵ��ܱ������У��ֱ����һ������SO2��O2(���У��׳���2 mol SO2��1 mol O2���ҳ���1 mol SO2��0.5 mol O2)��������Ӧ��2SO2(g)+O2 (g) ![]() 2SO3 (g) ��H= -197. 74 kJ/mol ��һ��ʱ���ﵽƽ�⣬�����������c(SO2)(mol/L)��ʱ��t(min)�ı仯��ϵ����ͼ��ʾ������˵����ȷ����______
2SO3 (g) ��H= -197. 74 kJ/mol ��һ��ʱ���ﵽƽ�⣬�����������c(SO2)(mol/L)��ʱ��t(min)�ı仯��ϵ����ͼ��ʾ������˵����ȷ����______
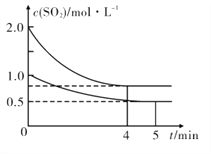
A���ų�������Q:Q(��)>2Q���ң�
B����ϵ��ѹǿp��p���ף�>2p(��)
C���������ﵽ��ѧƽ��ʱ���仯ѧƽ�ⳣ��Ϊ4
D�����������������䣬����ʼʱ�����г���0.4 mol SO2��0.2mol O2��0.4 molSO3�����ʱv(��>v(��)
(4)��ǿ���Եĵ����ˮ��Һ�У����Բ������缫�����CO2�ɵõ�����ȼ�ϣ���ԭ������ͼ��ʾ��
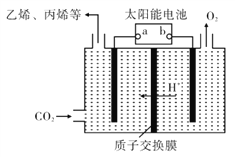
�ٸù���������ת����ʽ��Ҫ��____��
�ڵ��ʱ��������ϩ�ĵ缫��Ӧʽ��____��
(5)CO2����Ȼ��ѭ��ʱ����CaC03��Ӧ��Ca-CO3��һ���������ʣ���Ksp=2.8��10-9��CaCl2��Һ��Na2 CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2 CO3��Һ��ϣ���Na2 C03��Һ��Ũ��Ϊ2��10-4 mol��L�������ɳ�������CaCl2��Һ����СŨ��Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ���ֱ���20��00mL 0.10mol��L-1�İ�ˮ���������Һ�еμ�0.10mol��L-1������ᣬ��ҺpH��������������ı仯��ϵ��ͼ��ʾ������˵����ȷ����
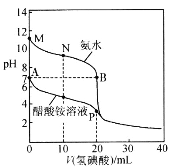
A.A����B����ˮ���������������Ũ��A�����B��
B.M�㣬c(NH3��H2O)>c(OH-)>c(H+)>c(NH4+)
C.N�㣬c(I-)=c(NH3��H2O)+c(NH4+)
D.P�㣬c(H+)+c(CH3COOH)=c(OH-)+c(I-)+c(NH3��H2O)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�к������ʾ��ȫȼ��ʱ���ÿ�ȼ����X(X=A��B��C)�����ʵ���n(x)���������ʾ����O2�����ʵ���n(O2)��A��B�����ֿ�ȼ���壬C��A��B�Ļ�����壬��C��n(A)��n(B)Ϊ �� ��

A. 2��1 B. 1��2 C. 1��1 D. �����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com