
【题目】(1)实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分,进行以下实验:取甲溶液,向其中缓慢滴入乙溶液,并边滴加边振荡,观察到开始无明显现象,后来有大量气体生成。实验过程中所发生反应的离子方程式为:___________________;甲是___________溶液,乙是____________溶液;
(2)为了达到下表所列的实验目的,请选择合适的实验方法,将其标号填在相应的空格中
____________;______________;____________;_______________;
【答案】CO32- + H+ = HCO3- HCO3- + H+ = H2O + CO2 ↑碳酸钠稀盐酸DCAB
【解析】
(1)当向盐酸中加入Na2CO3溶液时,发生反应2H++CO32-=CO2↑+H2O,盐酸完全反应后,再加入的Na2CO3不再放出CO2;向Na2CO3溶液中加入盐酸时,先发生反应CO32-+H+=HCO3-,当所有CO32-均转化为HCO3-时,再发生反应HCO3-+H+=CO2↑+H2O,开始无明显现象,后来有大量气体生成说明甲为HCl、乙为Na2CO3;
(2)氯化亚铁易被氧化为三价铁,三价铁离子遇硫氰化钾变红色;
食盐中少量细沙不溶于水,可溶于水后用过滤分离,然后蒸发结晶;
NaHCO3受热分解生成碳酸钠,故可用加热除去Na2CO3固体中少量的NaHCO3;铝粉可与氢氧化钠反应生成可溶性的偏铝酸钠,然后过滤得到镁;
故答案为:D;C;A;B。


科目:高中化学 来源: 题型:
【题目】0.5L 1mol/L FeCl3溶液与0.2L 1mol/L KCl溶液中的Cl﹣的物质的量浓度之比( )
A.5:2
B.3:1
C.15:2
D.1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在恒温条件下,将一定量X和Y的混合气体通入一容积为2 L的密闭容器中,X和Y两物质的浓度随时间变化情况如下图。
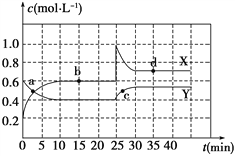
(1)该反应的化学方程式为(反应物或生成物用符号X、Y表示):____________________。
(2)0~10min化学反应速度V(X)=__________________。
(3)比较Y在0~10min和10~20min时平均反应速率的大小:v(0~10)_______ v(10~20)(填“<”、“>”或“=”),原因是________________。
(4) a、b、c、d四个点中,表示化学反应处于平衡状态的点是_________,理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积为2 L的密闭容器中充入2 mol A和1 mol B,在一定条件下发生反应:2A(g)+B(g)![]() 3C(g)经2 s达到平衡后,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
3C(g)经2 s达到平衡后,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
①用物质A表示该反应的平均反应速率为0.2 mol /(L·s)
②用物质B表示该反应的平均反应速率为0.2 mol /(L·s)
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
⑤其它条件不变,向容器中再加入1 molC气体,达到新平衡时,C的体积分数不变
A.①②③ B.①③⑤ C.②④⑤ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
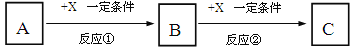
(1)若X是空气中存在的强氧化性无色气体单质,则A可能是___________(填序号)
a.C b.N2 c.S d.Al
(2)若X是日常生活中最常用的金属单质,A是气体单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,X在气体A中燃烧产生棕黄色的烟。
B的化学式为____________; 反应②的化学方程式为:___________________,
C溶液中加入NaOH溶液后产生的现象是_________________________, 方程式为____________________________________、_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外接电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:
铅蓄电池:Pb(s)+PbO2(s)+2H2SO4(aq)==2PbSO4(s)+2H2O(l);
电解池:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下各组判断正确的是( )
铅蓄电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法中,不能用于实验室制取氨的是
A. 在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热
B. 加热试管中的氯化铵固体
C. 将烧瓶中的浓氨水加热
D. 将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com