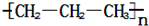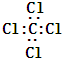考点:物质的量的相关计算,阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:(1)根据N=nNA计算出0.5molH2中的氢分子数;
(2)1mol氯化钠中含有1mol钠离子;
(3)硫酸分子中含有4个氧原子,1mol硫酸中含有4mol氧原子;
(4)氨气分子中含有4个原子,0.5mol氨气中含有2mol原子;
(5)二氧化碳分子中含有22个电子,1mol二氧化碳中含有22mol电子;
(6)1mol氯化镁中含有2mol氯离子、1mol镁离子,总共含有3mol离子.
解答:
解:(1)0.5molH2中的氢分子数为:N(H2)=0.5×NA=0.5NA,
故答案为:0.5NA;
(2)1molNaCl中含有1mol氯离子,含有的氯离子数为:1×NA=NA,
故答案为:NA;
(3)1molH2SO4中含有4mol氧原子,含有的氧原子数为:4×NA=4NA,
故答案为:4NA;
(4)0.5mol NH3中含有含有氨气分子数为0.5NA,氨气分子中含有4个原子,则0.5mol氨气中含有原子数为:0.5NA×4=2NA,
故答案为:0.5NA;2NA;
(5)二氧化碳分子中含有22个电子,含有的电子数为:22NA,
故答案为:22;22NA;
(6)1molMgCl2中含有2mol氯离子、1mol镁离子,总共含有3mol离子,则含有的氯离子数为2NA,含有的离子总数为:3NA,
故答案为:2NA;3NA.
点评:本题考查了物质的量的计算、阿伏伽德罗常数的应用,题目难度中等,试题题量稍大,注意掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间关系,明确有关物质的量的计算方法.