
| A. | 空气、Cl2 | B. | NaHCO3、蔗糖 | C. | Ba(OH)2、CH3CH2OH | D. | H2SO4、盐酸 |
分析 水溶液中或熔融状态下能够导电的化合物称为电解质,酸、碱、盐都是电解质;水溶液中和熔融状态下都不能导电的化合物称为非电解质,蔗糖、乙醇等都是非电解质;大多数的有机物都是非电解质;单质,混合物既不是电解质也不是非电解质.
解答 解:A、空气为混合物既不是电解质也不是非电解质,氯气为单质既不是电解质也不是非电解质,故A错误;
B、碳酸氢钠为电解质,蔗糖为非电解质,故B正确;
C、氢氧化钡为电解质,CH3CH2OH为非电解质,故C正确;
D、硫酸为电解质,而盐酸为混合物,既不是电解质也不是非电解质,故D错误;
故选BC.
点评 本题考查了电解质与非电解质的判断,题目难度不大,注意掌握电解质与非电解质的判断方法,单质和混合物既不是电解质,也不是非电解质.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:推断题
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制480mL 1mol•L-1的稀硫酸.
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制480mL 1mol•L-1的稀硫酸.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(N2)正=v(NH3)逆 | |
| B. | 单位时间内3 mol H-H发生断键反应,同时2 mol N-H发生也断键反应 | |
| C. | n(N2):n(H2):n(NH3)=1:3:2 | |
| D. | 反应混合物各组分的物质的量浓度不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
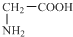

| A. | 全部 | B. | ①②④⑤⑥ | C. | ②③④⑤⑥ | D. | ②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是将电能转化为化学能的装置 | |
| B. | 原电池中发生氧化反应的是负极 | |
| C. | 电解池是将化学能转化为电能的装置 | |
| D. | 电解池中发生氧化反应的是阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
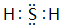 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com