
现用质量分数为98%、密度为1.84 g·cm-3的浓H2SO4来配制500 mL、0.2 mol·L-1的稀H2SO4。可供选择的仪器有:①玻璃棒②烧瓶③烧杯④胶头滴管⑤量筒⑥容量瓶⑦托盘天平⑧药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有 (填代号)。
(2)经计算,需浓H2SO4的体积为 mL(保留一位小数)。现有①10 mL ②50 mL ③100 mL三种规格的量筒,你选用的量筒是 (填代号)
(3)在配制过程中,其他操作都准确,下列操作中:错误的是 ,能引起实验结果偏高的有 (填代号)。
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
(1)②⑦⑧ (2分)
(2)5.4mL (2分) ;① (2分)
(3)① ② ③ ④ ⑥ ⑦ (2分) ;① ② ⑦ (2分)
解析试题分析:
(2)根据稀释定律:C(浓)·V(浓)=C(稀)·V(稀)可得需要浓硫酸5.4mL,量取液体时选择量程相差较小的量筒,所以选择10量筒。
(3)量筒在制造时已经考虑了倒不出来的部分,所以量筒不能再洗涤,否则会导致浓度偏高;容量瓶只能在室温下使用,只有等溶液冷却后才能转移,否则会导致浓度偏高;浓硫酸稀释时,只能往水中缓慢加入浓硫酸并用玻棒不断搅拌;定容时,水超过刻线,只能重新配制;定容摇匀后,有一部分水留在了瓶壁或瓶塞之间,不能加水,否则会导致浓度减小;定容时眼睛要平视凹液面最低处,俯视会导致浓度偏高。所以错误的有① ② ③ ④ ⑥ ⑦。能引起实验结果偏高的有① ② ⑦。
考点:考查一定物质的量浓度溶液的配制。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:计算题
已知反应:SO2+Cl2+2H2O=2HCl+H2SO4,若反应过程中消耗SO2标准状况下2.24L,
则:(1)求转移电子的数目。
(2)反应后溶液中H+的物质的量为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物。甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量。
甲组同学取了数分相同质量的样品A溶于水,然后分别加入不同体积的1mol/L的NaOH溶液,水浴加热至气体全部逸出。(此温度下,铵盐不分解)。该气体干燥后用足量的浓硫酸完全吸收。浓硫酸增重的质量与加入NaOH溶液的体积的关系如图。分析该图像,并回答下列问题: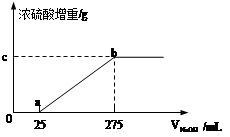
(1)写出ab段涉及的离子方程式: 。
(2)c点对应的数值是 ;样品A中(NH4)2SO4、NH4HSO4的物质的量之比为 。乙组同学取了数份不同质量的样品B,分别加入到200mL 1mol/L的NaOH溶液中,同样用水浴加热,将逸出气体干燥后再用浓H2SO4吸收。测定结果如下表:
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 铵盐的质量(g) | 9.88 | 19.76 | 29.64 | 49.40 |
| 浓硫酸增加的质量(g) | m | m | 1.36 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学实验小组制备硫酸亚铁铵晶体并设计实验测定其组成,他们进行了以下实验。
Ⅰ.向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到一种浅蓝绿色的硫酸亚铁铵晶体,这种晶体俗名“摩尔盐”,它比绿矾稳定得多。将摩尔盐低温烘干后,称取7.84 g加热至100 ℃失去结晶水,质量变为5.68 g。
Ⅱ.选择图所示的部分装置连接起来,检查气密性后,将上述5.68 g固体放入A装置的锥形瓶中,再向锥形瓶中加入足量NaOH浓溶液,充分吸收产生的气体并测出气体质量为0.68 g。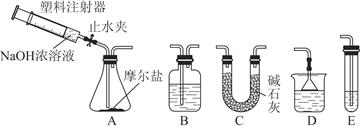
Ⅲ.向A中加入适量3%的H2O2溶液,充分振荡后滤出沉淀,洗净、干燥、灼烧后,测得其质量为1.6 g。
根据上述实验回答下列问题:
(1)实验Ⅰ中,“一系列操作”依次为________、________和过滤,要检验FeSO4溶液中是否含有Fe3+常用的试剂是________。
(2)实验Ⅱ中,选择的装置是A接________接________(填代号),A装置中未使用分液漏斗的理由是____________________________________________________________
(3)向锥形瓶中加入NaOH溶液的操作方法是_________________________________________________________
吸收A中产生的气体所用试剂应是________;实验小组的同学为保证A中产生的气体被完全吸收,以准确测量其质量,他们在A中反应停止后再进行的操作是__________________________________________________________
(4)根据上述实验数据计算,此摩尔盐中,n(NH4+)∶n(Fe2+)∶n(SO42—)∶n(H2O)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(10分)在常温常压下,可利用下列装置来测定气体体积,抽气装置E用以调节装置中的气压差,减小实验误差。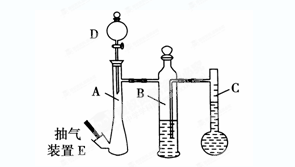
(1)若称取0.113g镁带与10.00 mL稀硫酸(足量)完全反应制取氢气,并测定1mol H2的体积(在常温常压下测定)。反应结束时C中的液面刻度为128.00 mL(A中未加硫酸时C中无液体),则得此条件下1mol H2的体积为________L(精确到0.001)。
(2)上述测出1mol H2的体积比该温度和压强下的理论值偏高的原因是(假设操作和装置都无问题)________(选填编号,下同)
A.未冷却到室温 B.反应太快
C.装置气密性不好 D.B装置漏气
(3)若利用上述装置测定CO2的气体摩尔体积。
①B中所盛放的液体应为________。
A.饱和Na2CO3溶液 B.饱和NaHCO3溶液
C.水 D.澄清石灰水
②仪器A、D中盛放的试剂应为________。
A.大理石,浓盐酸 B.纯碳酸钠,稀硫酸
C.纯碳酸钙,稀硫酸 D.纯碳酸钠,稀盐酸
(4)用以上装置测出的气体摩尔体积均比理论值大,你认为减小实验误差可行的措施是_______。
A.把A装置浸入盛水(常温)的水槽中
B.减小酸的浓度
C.把A装置浸入盛热水的水槽中
D.增大酸的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某一种胃药中的抑酸剂为碳酸钙,其中所含的抑酸剂质量的测定如下:
①需配制0.1 mol·L-1的HCl溶液和0.1 mol·L-1的NaOH溶液
②取一粒(药片质量相同) 0.2 g的此胃药片,磨碎后加入20.0 mL蒸馏水
③以酚酞为指示剂,用0.1 mol·L-1的NaOH溶液滴定,用去V mL达滴定终点
④加入25 mL 0.1 mol·L-1的HCl溶液
(1)写出实验过程的步骤(写编号顺序) 。
(2)下图所示容器中配制0.1 mol·L-1的HCl溶液和0.1 mol·L-1的NaOH溶液肯定不需要的仪器是(填序号) ,配制上述溶液还需要的玻璃仪器是 (填仪器名称)。 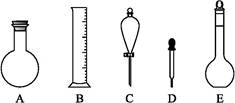
(3)配制上述溶液应选用的容量瓶规格是(填字母) 。
| A.50 mL 50 mL |
| B.100 mL 100 mL |
| C.100 mL 150 mL |
| D.250 mL 250 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
用氯化钠固体配制1.00mol/L的NaCl溶液95mL,回答下列问题
⑴所需仪器为:托盘天平、量筒、烧杯胶头滴管,若要完成实验,还需要两种玻璃仪器为 、 。
⑵该实验的实验步骤为:
①计算,②称量 gNaCl, ③溶解,④移液,⑤洗涤,⑥定容,⑦ 摇匀。
⑶试分析下列操作,对所配溶液的浓度有何影响。(用偏低、偏高、无影响填空)。
①用天平称量氯化钠后,发现砝码底部有锈斑。所配溶液的浓度 ;
②为加速固体溶解,微热烧杯溶液并不断搅拌。在未降至20℃时,就将溶液转移至容量瓶定容。所配溶液的浓度 ;
③容量瓶不干燥,含有少量蒸馏水。所配溶液的浓度 ;
④若定容时仰视刻度线。所配溶液的浓度 ;
⑤定容后,加盖、倒转、摇匀后,发现液面低于刻度线,又补加蒸馏水至刻度。则所配溶液的浓度 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于物质分类的说法正确的是
| A.氯化铵、次氯酸都属于强电解质 | B.漂白粉、石英都属于纯净物 |
| C.金刚石、白磷都属于单质 | D.葡萄糖、蛋白质都属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.红外光谱仪、质谱仪、核磁共振仪、紫外光谱仪和元素分析仪都是用于测定有机物结构的现代仪器 |
| B.工业上采用电解熔融氧化铝的方法冶炼铝,为了降低氧化铝的熔点,在实际生产中,向氧化铝中添加冰晶石 |
| C.化学家鲍林提出了氢键理论和蛋白质分子的螺旋结构模型,为DNA分子双螺旋结构模型的提出奠定了基础 |
| D.雾霾天气首要污染物为PM2.5(指大气中直径小于或等于2.5微米的颗粒物),PM2.5在空气中一定形成气溶胶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com