
【题目】在一密闭容器中,反应3A(g)+B(s)![]() 2C(g)+2D(g) ΔH >0达到平衡后,改变以下条件,下列说法正确的是( )
2C(g)+2D(g) ΔH >0达到平衡后,改变以下条件,下列说法正确的是( )
A. 增大压强,正、逆反应速率同等程度增大,平衡不移动
B. 升高温度,正反应速率增大,逆反应速率减小,平衡向正方向移动
C. 增加A的浓度,平衡向正方向移动,平衡常数增大
D. 增加B的用量,正、逆反应速率不变,平衡不移动
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】以重晶石(BaSO4)为原料,可按如下工艺生产立德粉(ZnS·BaSO4):
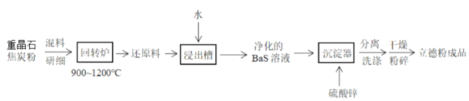
下列说法不正确的是
A.在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为BaSO4+4C![]() BaS+4CO↑
BaS+4CO↑
B.回转炉尾气中含有有毒气体,生产上可通过水蒸气变换将其转化为CO2和一种清洁能源气体,该反应的化学方程式为CO+H2O![]() CO2+H2
CO2+H2
C.在潮湿空气中长期放置的“还原料”。会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”表面生成了难溶于水的BaSO4
D.沉淀器中发生的离子反应方程式为:S2-+Ba2++Zn2++SO42-=ZnS·BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用如图装置做以下两个实验:
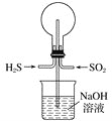
①常温下将H2S和SO2以物质的量之比为1∶1充满烧瓶,不久,烧瓶中能观察到的现象是_______。
②若用Cl2代替SO2,其他条件不变,观察到的现象与①相同之处为______,不同之处为_____;试用简要文字和化学方程式解释原因: ______。
③若想使②中反应后,烧瓶内产生“喷泉”现象,引发的操作为________。
(2)某课外活动小组利用如图所示装置进行实验:
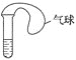
在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,因此溶液可能是_____溶液;加热时溶液由无色变为红色的原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中的反应热,表示燃烧热的是( )
A. NH3(g)+![]() O2(g)
O2(g)![]()
![]() N2(g)+
N2(g)+![]() H2O(g) ΔH=-a kJ·mol-1
H2O(g) ΔH=-a kJ·mol-1
B. C6H12O6(s)+6O2(g)![]() 6CO2(g)+6H2O(l) ΔH=-b kJ·mol-1
6CO2(g)+6H2O(l) ΔH=-b kJ·mol-1
C. C(s) +H2O(g) == CO(g)+H2(g) H=-c kJ·mol-1
D. CH3CH2OH(l)+![]() O2(g)
O2(g)![]() CH3CHO(l)+H2O(l) ΔH=-d kJ·mol-1
CH3CHO(l)+H2O(l) ΔH=-d kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),△H= —1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
A. 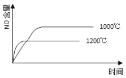
B. 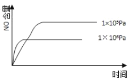
C. 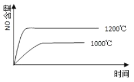
D. 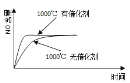
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾晶体(FeSO4·7H2O,M=278g/mol)是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为Fe2O3及少量FeS、SiO2),制备绿矾的过程如下:
 试回答:(1)操作Ⅰ为_____________(填写操作名称)。
试回答:(1)操作Ⅰ为_____________(填写操作名称)。
(2) 试剂Y与溶液X反应的离子方程式为__________________________________。
(3)检验所得绿矾晶体中含有Fe2+的实验操作是________________________________。
(4)操作Ⅲ的顺序依次为:_______________、冷却结晶、过滤 、__________、干燥。
(5)某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①步骤a配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需___________。
②该同学设计的下列滴定方式,最合理的是____________(夹持部分略去)(填字母序号)。
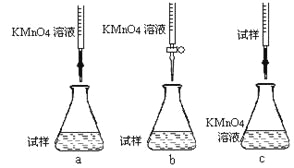
③滴定时发生反应的离子方程式为:_______________________________________。
④判断此滴定实验达到终点的方法是_____________________________;若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,其它操作均正确,则使测定结果________(填“偏高”“偏低”“无影响”)。
⑤计算上述样品中FeSO4·7H2O的质量分数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B是中学化学常见的化合物,它们各由两种元素组成;乙为元素R组成的单质,它们之间存在如图所示关系。根据要求回答问题:
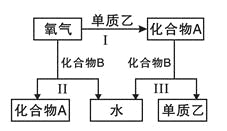
(1)上图三个反应中,属于氧化还原反应的有____个。
(2)若元素R与氧同主族,下列事实能说明R与氧的非金属性相对强弱的有____。
A.还原性:H2R>H2O B.酸性:H2R>H2O
C.稳定性:H2R<H2O D.沸点:H2R<H2O
(3)若化合物B常温下为气体,其水溶液呈碱性(答题必须用具体物质表示)。
①化合物B的电子式为______;其水溶液呈碱性的原因是______(用离子方程式表示)。
②化合物B可与O2组成燃料电池(氢氧化钾溶液为电解质溶液),其反应产物与反应Ⅲ相同。写出该电池负极的电极反应式______________________。
③当1mol的化合物B分别参与反应Ⅱ、Ⅲ时,热效应为△H1和△H2,则反应Ⅰ的热化学方程式为______________(注:反应条件相同、所有物质均为气体)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)是一种具有许多优良性能的金属,钛和钛合金被认为是21世纪的重要金属材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态电子排布式可表示为_____。
②与BH4-互为等电子体的阳离子的化学式为_____。
③H、B、Ti原子的第一电离能由小到大的顺序为_____。
(2)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如图所示。
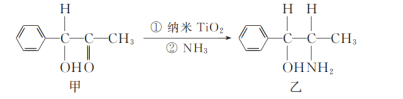
化合物乙的分子中采取sp3杂化方式的原子个数为_____。
(3)水溶液中并没有[Ti(H2O)6)]4+离子,而是[Ti(OH)2(H2O)4]2+离子,1mol[Ti(OH)2(H2O)4]2+中σ键的数目为____。
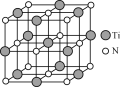
(4)氮化钛(TiN)具有典型的NaCl型结构,某碳氮化钛化合物,结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,则此碳氮化钛化合物的化学式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,能达到实验目的的是
A. 实验室制取氨气
实验室制取氨气
B.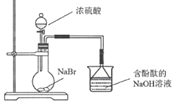 烧杯中红色褪去能证明生成HBr
烧杯中红色褪去能证明生成HBr
C. 实验室制取氧气
实验室制取氧气
D.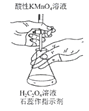 用酸性KMnO4溶液滴定HCO4溶液
用酸性KMnO4溶液滴定HCO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com