
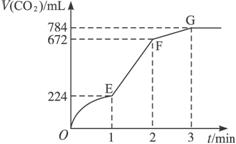
A.OE段表示的反应速率最快 B.EF段表示的反应速率最快
C.GF段收集的CO2最多 D.OG段表示反应速率越来越快
科目:高中化学 来源: 题型:阅读理解
| 化学式 | CaCO3 | CaSO3 | CaC2O4 | Mg(OH)2 |
| Ksp | 4.96×10-9 | 4.96×10-9 | 2.34×10-9 | 5.61×10-12 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
粗盐提纯的研究。
【有关资料】
| 化学式 | CaCO3 | CaSO3 | CaC2O4 | Mg(OH)2 |
| Ksp | 4.96×10-9 | 4.96×10-9 | 2.34×10-9 | 5.61×10-12 |
某研究性学习小组对粗盐的提纯和检验进行研究,并提出一些新的方案。已知该粗盐样品中主要含有不溶性杂质、Mg2+、Ca2+等(忽略SO42-的存在),该小组设计流程如下:
 【设计除杂过程】
【设计除杂过程】
(1)操作①中需要使用的玻璃仪器有 、 。操作②的名称为 。
(2)混合液A的主要成分是 。(填化学式)
【检验除杂效果】
(3)为检验溶液B中Mg2+、Ca2+是否除尽,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:检验Mg2+是否除尽。向其中一支试管中加入 溶液(填化学式),看是否有沉淀生成。
步骤二:检验Ca2+是否除尽。向另一支试管中加入某溶液,看是否有沉淀生成。效果最好的是 (填字母)。
A.Na2CO3 B.Na2SO3 C.Na2C2O4
【获取纯净食盐】
(4)对溶液B加热并不断滴加6 mol·L-1的盐酸溶液,同时用pH试纸检测溶液,直至pH=2时停止加盐酸,得到溶液C,该操作的目的是 。
(5)将溶液C倒入 (填仪器名称)中,加热蒸发并用玻璃棒不断搅拌,直到 时(填现象),停止加热。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com