



 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:阅读理解
2- 4 |

2- 4 |
2- 4 |
2- 4 |
2- 4 |
2- 4 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| aNa |
| 58.5 |
| b |
| 58.5 |
| b |
| a |
查看答案和解析>>
科目:高中化学 来源:2014届四川省高一上学期期中联考化学试卷 题型:实验题
(10分)我省自贡盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用,没有食盐的生活是不可以想象的。粗盐中含有Ca2+、Mg2+、SO42-以及泥沙等杂质,
(1)为了除去粗盐中的泥沙,可采用的实验操作方法的名称是____▲____
(2)为了除去可溶性杂质,可以按以下实验步骤进行提纯:①加过量BaCl2溶液;②加过量NaOH溶液;③加过量Na2CO3溶液;④过滤;⑤加适量盐酸。
其中,在步骤③中涉及的离子反应方程式有___ ▲ ; ▲ 。
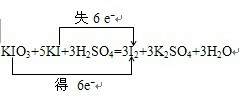
(3)含碘食盐往往加入KIO3,为了检验实验中是否含KIO3,可以用以下反应进行:
KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O
为了从反应后的溶液中提取得到纯净的I2,可采用的实验操作方法的名称是___▲__ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com