
【题目】酸雨的形成主要是由于( )
A.森林遭到乱砍滥伐
B.含硫化石燃料的大量燃烧
C.大气中二氧化碳的含量增大
D.含氮、磷的废水任意排放
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. NaHSO4水溶液能使石蕊变红,但NaHSO4不是酸
B. 有单质参加或有单质生成的反应一定是氧化还原反应
C. 酸性氧化物一定是非金属氧化物
D. 1molCl2的体积是22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A. 1mol Cl2参加化学反应,转移的电子数一定为2NA
B. 7.8g Na2O2 晶体中阴阳离子总数为0.4NA
C. 15.6 g Na2O2与过量CO2反应时,转移的电子数为0.2NA
D. 标准状况下,由0.5mol NO和0.5mol O2组成的混合气体,分子数约为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点。下图是某同学用0.1mol/L KOH 溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH 溶液滴定曲线示意图(混合溶液体积变化忽略不计)。下列有关判断不正确的是
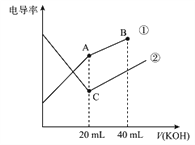
A. 曲线①代表0.1mol/L KOH 溶液滴定CH3COOH溶液的滴定曲线,曲线②代0.1mol/LKOH 溶液滴定HCl溶液的滴定曲线
B. 在相同温度下,C点水电离的c (H+) 大于A点水电离的c(H+)
C. 在A 点的溶液中有: c(CH3COO-)+c(OH-)-c (H+)=0.05mol/L
D. 在B 点的溶液中有: c(K+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是中学化学实验室的常见药品,回答下列问题:
I.配制一定物质的量浓度的硫酸溶液:
(1)某次实验大约需要1mol/L硫酸溶液435mL。同学们发现实验室内没有450mL的容量瓶,某同学提议用1个200mL容量瓶和1个250mL容量瓶来配制,你认为该提议______(填“合理”、“不合理”)。
(2)实验中要配制0.5mol/L H2SO4溶液250mL,则需量取密度为1.84g/mL、98%的浓硫酸________mL(结果保留小数点后一位)。
Ⅱ.蔗糖与浓硫酸的炭化实验会产生大量的有刺激性气味的气体,会对环境造成污染。 某实验小组利用如下装置对该实验进行改进。回答下列问题:

注:硬质玻璃管中①、②、③处分别为滴有Na2S溶液的滤纸、滴有品红溶液的滤纸、滴有酸性KMnO4溶液的滤纸,a和b分别为两个小气球。
(3)实验开始后先关闭活塞K,硬质玻璃管中①号试纸变黄,②号和③号滤纸均褪色,a处气球变大。硬质玻璃管中实验现象说明炭化实验产生的刺激性气味气体是 SO2,
①、②、③处发生的变化分别说明SO2具有_______、________和__________(填SO2表现出的性质)。
(4)SO2和Cl2均可以使品红溶液褪色,但将两种气体按体积比1:1混合通入品红溶液中,品红溶液不褪色,其原因是___________(用化学方程式回答)。
(5)打开活塞K, a处气球变小,b处气球变大。使三颈烧瓶内气体缓慢通过B瓶和C瓶,一段时间之后,发现澄清石灰水变浑浊。为证明有CO2生成,可以在④号位罝的滤纸滴加_______溶液,该试剂的作用是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(g)+5B(g)4C(g)+6D(g) 在5L的密闭容器中进行反应,30min后,C的物质的量增加了0.30mol.下列叙述正确的是( )
A.30min中A的平均反应速率是0.010molL﹣1min﹣1
B.容器中D的物质的量一定增加了0.45mol
C.容器中A,B,C,D的物质的量的比一定是4:5:4:6
D.容器中A的物质的量一定增加0.30mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的废金属屑的主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠)等产品,过程如下:
I.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
Ⅱ.向I所得固体中加入过量稀H2SO4,充分反应后过滤;
Ⅲ.向Ⅱ所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
Ⅳ.……
(1)步骤I 中发生反应的化学方程式为___________、___________ 。
(2)步骤Ⅱ所得的滤液中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其可能的原因: ___________ 。
(3)步骤Ⅲ获得CuSO4 溶液的离子方程式为___________ 。
(4)步骤II 所得滤液经进一步处理可制得Na2FeO4,流程如下:
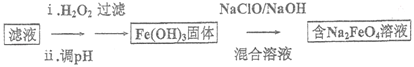
①测得滤液中c(Fe2+)为a mol/L,若要处理1m3滤液,理论上需要消耗25%的H2O2溶液___________kg(用含a 的代数式表示)。
②写出由Fe(OH)3制取Na2FeO4的化学方程式: ___________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com