
 已知金属活动相差越大,形成原电池时越容易放电.请根据如图装置,回答下列问题:
已知金属活动相差越大,形成原电池时越容易放电.请根据如图装置,回答下列问题:

科目:高中化学 来源: 题型:
| 2SO2(g)+O2(g)?2SO3(g) | N2(g)+3H2(g)?2NH3(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
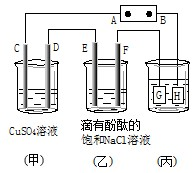 如图装置所示,C、D、E、F都是惰性电极,
如图装置所示,C、D、E、F都是惰性电极,查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 一种新型酸性乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍,电池反应式为C2H5OH+3O2=2CO2+3H2O,电池构造如图.下列关于该电池的说法不正确的是
一种新型酸性乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍,电池反应式为C2H5OH+3O2=2CO2+3H2O,电池构造如图.下列关于该电池的说法不正确的是| A、放电过程中,电源内部的H+从正极区向负极区迁移 |
| B、通入乙醇的电极是负极 |
| C、该电池的正极反应为:4H++O2+4e-=2H2O |
| D、用该电池做为电源,用惰性电极电解饱和NaCl的水溶液时,每消耗0.2 mol C2H5OH,阳极产生标准状况下气体的体积为26.88 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | HX | HY | HZ | ||
| 浓度(mol/L) | 0.12 | 0.2 | 0.9 | 1 | 1 |
| 电离度 | 0.25 | 0.2 | 0.1 | 0.3 | 0.5 |
| 电离常数 | K1 | K2 | K3 | K4 | K5 |
| A、在相同温度,从HX的数据可以说明:弱电解质溶液,浓度越低,电离度越大,且K1>K2>K3 | ||
B、室温时,若在NaZ溶液中加水,则
| ||
| C、等物质的量的NaX、NaY和NaZ的混合,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-) | ||
| D、在相同温度下,K5>K4>K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | ||||
| B、铝和氢氧化钠溶液反应:Al+OH-+3H2O═Al(OH)4-+H2↑ | ||||
| C、向次氯酸钠溶液中通入足量SO2 气体:ClO-+SO2+H2O═HClO+HSO3- | ||||
D、向沸水中逐滴加入FeCl3饱和溶液:Fe3++3H2O
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com