
【题目】正确认识和使用电池有利于我们每一个人的日常生活。电化学处理SO2是目前研究的热点,利用双氧水氧化吸收SO2是目前研究的热点。
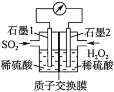
(1)反应的总化学方程式为___,正极的电极反应式为___。
(2)H+的迁移方向为由___到___(填“左”或“右”)。
(3)若11.2L(标准状况)SO2参与反应,则迁移H+的物质的量为___。
(4)下列化学电池不易造成环境污染的是___(填字母)。
A.氢氧燃料电池 B.锌锰电池 C.镍镉电池 D.铅蓄电池
(5)某同学关于原电池的笔记中,不合理的有___(填序号)。
①原电池两电极活泼性一定不同
②原电池负极材料参与反应,正极材料都不参与反应
③Fe-NaOH溶液-Si原电池,Fe是负极
【答案】H2O2+SO2=H2SO4 H2O2+2e-+2H+=2H2O 左 右 1mol A ①②③
【解析】
该原电池中,通入二氧化硫的电极上失电子发生氧化反应,则通入二氧化硫的电极是负极、电极反应为:SO2+2H2O-2e-=H2SO4+2H+,通入双氧水的电极是正极,正极上双氧水得电子生成水,电极反应为:H2O2+2e-+2H+=2H2O,原电池中阳离子移向正极;根据转移电子和转移氢离子之间的关系式计算;从环境保护方面分析;根据原电池的形成条件判断。
(1)该原电池中,通入二氧化硫的电极上失电子发生氧化反应,则通入二氧化硫的电极是负极,通入双氧水的电极是正极,正极上双氧水得电子生成水,电极反应式为H2O2+2e-+2H+=2H2O,原电池总反应化学方程式为:H2O2+SO2=H2SO4;
(2)阳离子移向正极,H+的迁移方向为正极,从质子交换膜左侧向右侧迁移;
(3)n(SO2)=![]() ,该反应的负极反应式为SO2+2H2O-2e-=H2SO4+2H+,正极电极反应式为H2O2+2e-+2H+=2H2O,有0.5mol二氧化硫参加反应,转移的电子的物质的量为1mol,根据根据正极的电极反应可知,转移2mol电子时,迁移2mol H+,转移1mol电子时,迁移1mol H+;
,该反应的负极反应式为SO2+2H2O-2e-=H2SO4+2H+,正极电极反应式为H2O2+2e-+2H+=2H2O,有0.5mol二氧化硫参加反应,转移的电子的物质的量为1mol,根据根据正极的电极反应可知,转移2mol电子时,迁移2mol H+,转移1mol电子时,迁移1mol H+;
(4)A.氢氧燃料电池生成物为水,无污染,故A正确;
B.锌锰电池中含有重金属锰,对环境有污染,故B错误;
C.镍镉电池中含有重金属镍镉,对环境有污染,故C错误;
D.铅蓄电池中含有铅元素,对环境有污染,故D错误;
答案选A;
(5)①原电池两电极活泼性可以相同,如氢氧燃料电池电极材料为石墨,所以不一定不同,故①错误;
②原电池负极材料参与反应,正极材料也可以参与反应,如铅蓄电池中正极材料PbO2和负极材料Pb都参加反应,故②错误;
③FeNaOH溶液Si原电池,铁和氢氧化钠不能发生反应,硅和氢氧化钠发生氧化还原反应,Si是负极,Fe为正极,故③错误;
故答案为:①②③。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是
A. Na![]() Na2O
Na2O![]() Na2CO3
Na2CO3
B. Al![]() Al2O3
Al2O3![]() Al(OH)3
Al(OH)3
C. Fe(OH)2![]() Fe(OH)3
Fe(OH)3![]() Fe2O3
Fe2O3
D. Na2CO3(aq)![]() NaHCO3
NaHCO3![]() CO2
CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解是一种非常强有力的促进氧化还原反应的手段,许多很难进行的氧化还原反应,都可以通过电解来实现。
(1)工业上常以石墨做电极,电解NaCl水溶液时,阴极区产物有____,其溶液可用于吸收工业尾气中的SO2,写出反应的化学方程式_____。
(2)电解NaCl水溶液时,用盐酸控制阳极区溶液的pH在2~3,用平衡移动原理解释盐酸的作用_____。离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上发生电镀,有铝产生。
(3)铝原子的核外电子排布式是____,其中有____种不同能级的电子。
(4)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当所得还原产物为6g时,转移电子的物质的量为___mol。
(5)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有____(填编号)。
a.KClO3 b.Mg c.MnO2 d.KCl
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,不能说明固体混合物中无Fe2O3,理由是________(用离子方程式说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A |
| 装置气密性良好 |
B | 将氧化铁加入到足量的HI溶液中,充分溶解后,滴加四氯化碳,震荡静置,下层呈紫红色。 | I2氧化性强与Fe3+ |
C | 往氢氧化铜沉淀中分别滴加盐酸和氨水,沉淀皆溶解 | 氢氧化铜为两性氢氧化物 |
D | 将SO2通入Na2CO3溶液中生成的气体,通入澄清石灰水中有浑浊 | 说明酸性:H2SO3﹥H2CO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示,则下列 离子组在对应的溶液中一定能大量共存的是
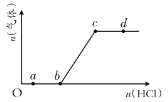
A.a点对应的溶液中:Fe3+、AlO2-、SO42-、NO3-
B.b 点对应的溶液中:K+、Ca2+、I-、Cl-
C.c 点对应的溶液中:Na+、Ca2+、NO3-、Ag+
D.d 点对应的溶液中:F-、NO3-、Fe2+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组,将剪下的一块镀锌铁放入试剂瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞溶液,按图装置进行实验,数分钟后观察,下列现象不可能出现的是( )

A. B中导气管里形成一段水柱
B. B中导气管中产生气泡
C. 金属片剪口处溶液变红
D. 锌被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL 0.3mol·L-1 Na2SO4溶液和50mL 0.2mol·L-1 Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为(假设混合前后溶液体积变化忽略不计)( )
A.0.20mol·L-1B.0.25mol·L-1C.0.40mol·L-1D.0.50mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,在三个容积均为1L的恒容密闭容器中仅发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
容器 编号 | 容器类型 | 起始物质的量 / mol | 平衡时SO3的物质的量 / mol | ||
SO2 | O2 | SO3 | |||
I | 恒温恒容 | 2 | 1 | 0 | 1.8 |
II | 恒温恒压 | 2 | 1 | 0 | a |
III | 绝热恒容 | 0 | 0 | 2 | b |
A. 容器I中SO2的转化率小于容器II中SO2的转化率
B. 容器II的平衡常数大于容器III中的平衡常数
C. 平衡时SO3的物质的量:a>1.8、b>1.8
D. 若起始时向容器I中充入0.10 mol SO2(g)、0.20mol O2(g)和2.0 mol SO3(g),则此时v正<v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是化学必修2第64页配图(氢原子已省略),请根据下图回答有关问题;
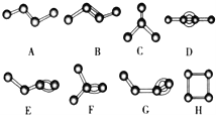
(1)属于烯烃类的有 ________(填编号);
(2)写出化合物B的结构简式 _________,H的分子式 ___________;
(3)指出上图有机化合物中官能团的名称 _______________
(4)A和C的关系是 ______________
(5)D与G的关系是 ___________________
(6)有机物种类繁多的原因有 ________________________(至少答两种原因)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com