
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②将一小块金属钠放入滴有酚酞溶液的冷水中 | B.有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | C.反应不十分剧烈;产生无色气体 |
| ④将铝条投入稀盐酸中 | D.剧烈反应,迅速产生大量无色气体 |
| 实验内容 | ① | ② | ③ | ④ |
| 实验现象(填A~D) |
分析 (1)实验目的为同周期元素性质递变规律;
(2)根据物质的性质判断实验现象:镁与热水反应生成氢气,有气泡产生,反应生成氢氧化镁,溶液呈碱性;钠和冷水反应生成氢氧化钠和氢气;镁条投入稀盐酸中,剧烈反应,迅速产生大量氢气;铝条投入稀盐酸中,反应不十分剧烈,产生氢气;
(3)镁与热水反应生成氢气、氢氧化镁;铝和盐酸反应生成氯化铝和氢气,据此回答;
(4)根据实验现象结合实验目的得出结论.
解答 解:(1)由题目可知,表中的内容研究的是金属钠镁铝的性质,实验目的为探究同周期金属元素性质递变规律,
故答案为:金属;
(2)将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾,镁与热水反应生成氢气,有气泡产生,反应生成氢氧化镁,溶液呈碱性,再向溶液中滴加酚酞溶液,溶液呈红色;
金属钠较活泼,放入滴有酚酞溶液的冷水中因为生成氢氧化钠而使得溶液显示红色,同时还会产生氢气,现象有:浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色;
镁较铝活泼,但都能与盐酸发生置换反应,将镁条投入稀盐酸中,剧烈反应,迅速产生大量无色气体;
将铝条投入稀盐酸中,反应不十分剧烈,产生无色气体.
故答案为:
| 实验内容 | ① | ② | ③ | ④ |
| 实验现象 | B | A | D | C |
点评 本题考查同周期元素性质递变规律,题目难度中等,注意物质的性质以及元素周期律的递变规律,侧重于考查学生的实验探究能力和分析应用基础知识的能力.


科目:高中化学 来源: 题型:选择题

| A. | 金属Mg采用②堆积方式 | |
| B. | ①和③中原子的配位数分别为:8、12 | |
| C. | 对于采用②堆积方式的金属,实验测得W g该金属的体积为V cm3,则阿伏加德罗常数NA的表达式为$\frac{MV}{W•(\frac{4}{\sqrt{3}}r)^{3}}$ | |
| D. | ④中空间利用率的表达式为:$\frac{\frac{4}{3}π{r}^{3}×4}{(\frac{4}{\sqrt{2}}r)^{3}}$×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
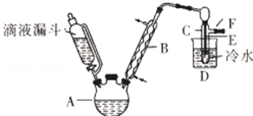 已知:R-OH+HX→R-X+H2O如图是实验室用乙醇与浓硫酸和溴化钠反应制备溴乙烷的装置,图中省去了加热装置.乙醇、溴乙烷、溴有关参数数据见表:
已知:R-OH+HX→R-X+H2O如图是实验室用乙醇与浓硫酸和溴化钠反应制备溴乙烷的装置,图中省去了加热装置.乙醇、溴乙烷、溴有关参数数据见表:| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
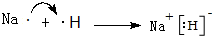 .
.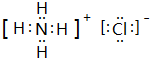 ,A2C2的电子式为
,A2C2的电子式为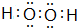 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用 | |
| B. | 减少机动车尾气的排放,可以降低雾霾的发生 | |
| C. | 利用生物方法脱除生活污水中的氮和磷,可防止水体富营养化 | |
| D. | 绿色食品是生产时不使用化肥农药,不含任何化学物质的食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属钛(Ti)被称为21世纪金属,在航海、航空、记忆和涂料方面应用广泛,TiO2是一种优良的光催化剂.20世纪科学家尝试用多种方法将金红石(TiO2)还原,发现金红石直接氯化是冶炼钛的关键步骤:
金属钛(Ti)被称为21世纪金属,在航海、航空、记忆和涂料方面应用广泛,TiO2是一种优良的光催化剂.20世纪科学家尝试用多种方法将金红石(TiO2)还原,发现金红石直接氯化是冶炼钛的关键步骤:| 实验组别 | 1 | 2 | 3 | 4 |
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
| O2生成量/(10-6mol) | 3.6 | 4.4 | 4.5 | 1.5 |
| 反应时间/h | 3 | 3 | 3 | 3 |
| 容器体积/L | 2 | 2 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
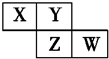 X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | 气态氢化物溶液的pH:X>Y>W | |
| D. | Y的氢化物的沸点低于同族元素Z的氢化物的沸点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com