
【题目】【2016届北京西城一模】Cu2O可用于制作船底防污漆,某学习小组探究制备Cu2O的方法。
【查阅资料】
① CuSO4与Na2SO3溶液混合可制备Cu2O。
② Cu2O为砖红色固体;酸性条件下生成Cu2+和Cu。
③ Cu2O和Cu(SO3)23-可以相互转化 ![]()
(1)配制0.25 mol·L-1CuSO4溶液和0.25 mol·L-1 Na2SO3溶液。测得CuSO4溶液pH=4,Na2SO3溶液
pH=9。用离子方程式表示CuSO4溶液pH=4的原因_______。
(2)完成CuSO4溶液和Na2SO3溶液反应制Cu2O的离子方程式:
![]()
【实验探究】
操作 | 现象 |
| i 有黄色沉淀出现,随着 Na2SO3溶液的滴入,沉淀增加,当加到5 mL时,溶液的蓝色消失。 ii 将试管加热,黄色沉淀变为砖红色,有刺激性气味气体产生。 iii在加热条件下,继续滴入Na2SO3溶液,砖红色沉淀减少,当1加到10 mL时,沉淀完全溶解,得无色溶液。 |
(3)证明ii中砖红色沉淀是Cu2O的实验方案是_________________。
(4)经检验i中黄色沉淀含有Cu2SO3,ii中沉淀由黄色变砖红色的化学方程式是________________。
(5)iii中砖红色沉淀消失的原因是_________________。
(6)在加热条件下,若向2 mL 0.25 mol·L-1Na2SO3溶液中滴加0.25 mol·L-1CuSO4溶液至过量,预期观察到的现象是_________________。
(7)由上述实验得出结论:CuSO4溶液和Na2SO3溶液反应制备Cu2O,应控制的条件是_______、_______。
【答案】(15分)(1)Cu2++2H2O![]() Cu(OH)2+2H+(2)2, 5,2H2O,1,1SO42-,4
Cu(OH)2+2H+(2)2, 5,2H2O,1,1SO42-,4
(3)取少量砖红色沉淀于试管中,加入稀硫酸,溶液变为蓝色,说明砖红色沉淀是Cu2O
(4)Cu2SO3![]() Cu2O+SO2↑ (5)Cu2O转化得无色Cu(SO3)23-
Cu2O+SO2↑ (5)Cu2O转化得无色Cu(SO3)23-
(6)开始先产生沉淀,振荡后溶解,后来产生砖红色沉淀,且沉淀不消失
(7)反应温度;CuSO4和Na2SO3的物质的量之比
【解析】
试题分析:(1)硫酸铜是强酸弱碱盐,Cu2+水解导致溶液显酸性,所以用离子方程式表示CuSO4溶液pH=4的原因是Cu2++2H2O![]() Cu(OH)2+2H+。
Cu(OH)2+2H+。
(2)根据方程式提供的信息,Cu2+体现氧化性,得电子生成Cu2O,SO32-则具有还原性,失电子生成SO42-,根据化合价升降相等,然后根据电荷守恒和原子守恒配平,得到的离子方程式为2Cu2++5SO32-+2H2O =Cu2O+SO42-+4HSO3-。
(3)根据信息②可知,在酸性条件下Cu2O可发生歧化反应生成Cu2+和Cu,所以证明ii中砖红色沉淀是Cu2O的实验方案是取少量砖红色沉淀于试管中,加入稀硫酸,溶液变为蓝色,说明砖红色沉淀是Cu2O。
(4)据题意,经检验i中黄色沉淀含有Cu2SO3,ii中Cu2SO3沉淀在加热的条件下发生分解反应生成砖红色Cu2O,并且有刺激性气味气体产生,该气体为SO2,则反应的方程式是Cu2SO3![]() Cu2O+SO2↑。
Cu2O+SO2↑。
(5)通过资料③提供的信息,Cu2O和Cu(SO3)23-可以相互转化,![]() ,SO32-浓度升高,平衡正移,生成无色的Cu(SO3)23-,沉淀消失。
,SO32-浓度升高,平衡正移,生成无色的Cu(SO3)23-,沉淀消失。
(6)此问中实验过程和原题操作不同的地方是Na2SO3溶液和CuSO4溶液的滴加顺序,先看到的是CuSO4少量时的现象,对应原题中iii的“沉淀溶解,无色溶液”现象。之后CuSO4滴加至过量,并且有加热条件,应看到的是原过程中ii的“砖红色沉淀,并有刺激性气味气体”现象。所以预期观察到的现象是开始先产生沉淀,振荡后溶解,后来产生砖红色沉淀,且沉淀不消失。
(7)对比原实验中i和ii,可证明“加热”是产生砖红色沉淀的必要条件。对比原实验ii和iii以及(6)中过程,可证明加入过量的Na2SO3时无Cu2O产生。另外如果Na2SO3加入量过少,则认为还原剂量少,生成Cu2O量不足,CuSO4和Na2SO3的物质的量之比是产生砖红色沉淀的必要条件。


科目:高中化学 来源: 题型:
【题目】铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下: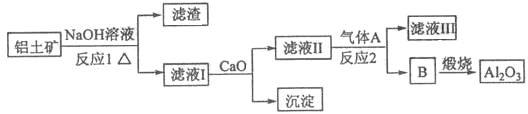
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下: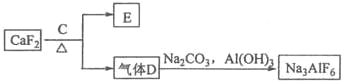
回答下列问题:
(1)写出反应1的化学方程式___________________________ ;
(2)滤液Ⅰ中加入CaO生成的沉淀是 ,反应2的离子方程式为_______________ ;
(3)E可作为建筑材料,化合物C是_____ ,写出由D制备冰晶石的化学方程式 ____________;
(4)电解制铝的化学方程式是 _____________________________________,以石墨为电极,阳极产生的混合气体的成分是 _________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年1月《中国科学报》报道,又有 113号、115号、117号和118号四种元素被载入元素周期表。其中118号元素的原子符号为294 118Uuo,“294”是指该原子的
A. 原子序数 B. 电子数 C. 中子数 D. 质量数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题。
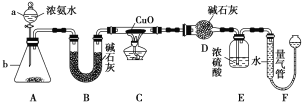
(1)仪器a的名称为________;仪器b中可选择的试剂为__________。
(2)实验室中,利用装置A,还可制取的无色气体是________(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管中有无色无味的气体产生,上述现象证明NH3具有________性,写出相应的化学方程_ 。
(4)装置E中浓硫酸的作用是_______________________。
(5)读取气体体积前,应对装置F进行的操作:________________________。
(6)实验完毕,若测得干燥管D增重m g,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比值为________(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在溶液中大量共存的一组是
A.Mg2+、Al3+、Cl-、OH-
B.Na+、Ba2+、OH-、SO42—
C.K+、Na+、NO3—、HCO3—
D.K+、NH4+、CO32—、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】均由两种短周期元素组成的A、B、C、D化合物分子,都含有18个电子,它们分子中所含原子的数目依次为2、3、4、6.A和C分子中的原子个数比为1:1,B和D分子中的原子个数比为1:2.D可作为火箭推进剂的燃料.请回答下列问题:
(1)A、B、C、D分子中相对原子质量较大的四种元素第一电离能由大到小排列的顺序为 (用元素符号回答).
(2)A与HF相比,其熔、沸点较低,原因是 .
(3)B分子的空间构型为 形,该分子属于 分子.(填“极性”或“非极性”)
(4)C为一种绿色氧化剂,有广泛应用.请写出Cu、稀H2SO4与C反应制备硫酸铜的离子方程式: ,该反应中反应物Cu原子的基 态电子排布式为 .铜晶体中铜原子的堆积方式为面心立方堆积,如图是铜晶体一个晶胞的示意图,则晶胞中含 个铜原子.
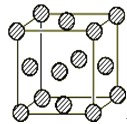
(5)D分子中心原子的杂化方式是 ,由该原子组成的单质分子中包含 个π键,与该单质分子互为等电子体的常见分子的分子式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,2.24L苯含有的分子数为0.1NA
B.标准状况下,11.2L乙烷中含有共价键的数目为3NA
C.常温下,1mol羟基中含有的电子数为9NA
D.1mol冰醋酸和1mol乙醇在浓硫酸加热下充分反应生成H2O个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)已知下列反应:SO2(g)+2OH (aq) ===SO32 (aq)+H2O(l) ΔH1
ClO (aq)+SO32 (aq) ==SO42 (aq)+Cl (aq) ΔH2 CaSO4(s) ==Ca2+(aq)+SO42(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) === CaSO4(s) +H2O(l) +Cl (aq)的ΔH=______。(用ΔH1 ΔH2ΔH3表示)
(2)工业上用H2和Cl2反应制HCl,各键能数据为:H﹣H:436kJ/mol,Cl﹣Cl:243kJ/mol,H﹣Cl:431kJ/mol.该反应的热化学方程式是 。
(3)合成气(CO和H2为主的混合气体)不但是重要的燃料也是重要的化工原料,制备合成气的方法有多种,用甲烷制备合成气的反应为:
①2CH4(g)+O2(g)═2CO(g)+4H2(g);△H1=﹣72kJ·mol﹣1
②CH4(g)+H2O(g)═CO(g)+3H2(g);△H2=+216kJ·mol﹣1
氢气与氧气反应生成水蒸气的热化学方程式为 。
现有1mol由H2O(g)与O2组成的混合气,且O2的体积分数为x,将此混合气与足量CH4充分反应.若x=0.2时,反应①放出的能量为 kJ;若x= 时,反应①与②放出(或吸收)的总能量为0。
(4) 一定条件,在水溶液中1 mol Cl-和1 mol ClOx-(x=1,2,3,4)的能量(KJ)相对大小如图所示
。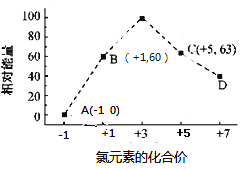
①D是 (填离子符号)。
②B→A+C反应的热化学方程式为 (用离子符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com