
����Ŀ��ij����С��������CuO��NH3��Ӧ���о�NH3��ij�����ʲ��ⶨ����ɣ����������ʵ��װ��(�г�װ��δ����)����ʵ�顣��ش��������⡣
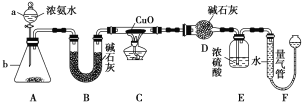
��1������a������Ϊ________������b�п�ѡ����Լ�Ϊ__________��
��2��ʵ�����У�����װ��A��������ȡ����ɫ������________(����ĸ)��
A��Cl2 B��O2 C��CO2 D��NO2
��3��ʵ���й۲쵽װ��C�к�ɫCuO��ĩ��Ϊ��ɫ���壬������������ɫ��ζ�������������������֤��NH3����________�ԣ�д����Ӧ�Ļ�ѧ����_ ��
��4��װ��E��Ũ�����������_______________________��
��5����ȡ�������ǰ��Ӧ��װ��F���еIJ�����________________________��
��6��ʵ����ϣ�����ø����D����m g��װ��F�����������Ϊn L(������ɱ�״��)�������е������ԭ�Ӹ�����ֵΪ________(�ú�m��n��ĸ�Ĵ���ʽ��ʾ)��
���𰸡���1����Һ©�� ��ʯ��(�����ƻ��������ƹ�����ʯ��)
��2��BC��3����ԭ(1��) 3CuO��2NH33Cu��3H2O��N2
��4������δ��Ӧ�İ�������ֹF��ˮ��������D
��5�����������ƶ��ұ�©����ʹ��������Һ����ƽ��6��![]()
��������
�����������1��װ��������aΪ��Һ©��������b�����÷�Һ©���е���İ�ˮʹ��ƿ�еĹ����ܽ���ȴٽ�һˮ�ϰ��ֽ����ɰ������������ƹ��塢�����ƹ��塢��ʯ�ҹ��壬
��2������װ��A������ȡ����ɫ���壻
A���Ʊ�����Cl2��Ҫ���ȣ�������Ϊ����ɫ���壬��A�����ϣ�
B�������Ʊ�O2�����ù���������ƺ�ˮ�ķ�Ӧ����B���ϣ�
C�������Ʊ�CO2 ���壬����ϡ����������ʯ�Ϸ�Ӧ���ɣ���C���ϣ�
D��NO2�Ǻ���ɫ���壬��D�����ϣ�
��3��ʵ���й۲쵽װ��C�к�ɫCuO��ĩ��Ϊ��ɫ���壬����������ɫ��ζ�����壬˵������������ͭ��Ӧ����ͭ�͵�����ˮ������������ͭ�������ֻ�ԭ�ԣ����ԭ���غ���ƽд���Ļ�ѧ����ʽΪ��3CuO+2NH3![]() 3Cu+3H2O+N2 ����4���������̷�����Ũ���������չ����İ�������ֹF��ˮ��������DӰ��ʵ��Ч����
3Cu+3H2O+N2 ����4���������̷�����Ũ���������չ����İ�������ֹF��ˮ��������DӰ��ʵ��Ч����
��5����ȡ�������ǰ��Ӧ��װ��F���еIJ��������������ƶ��ұ�©����ʹ��������Һ����ƽ������ѹǿƽ���ٶ������ʴ�Ϊ�����������ƶ��ұ�©����ʹ��������Һ����ƽ��
��6������ø����D����mgΪˮ���ʵ���=![]() ��װ��F�����������ΪnL��������ɱ�״����ΪN2�����ʵ���=
��װ��F�����������ΪnL��������ɱ�״����ΪN2�����ʵ���=![]()
������Ԫ���غ�õ���ԭ�Ӻ���ԭ�����ʵ���֮��=![]() ��
��![]() =
=![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2016������һģ������( PH3)��һ�־綾���壬����õĸ�ЧѬ��ɱ�����Ҳ��һ�ֵ��ӹ�ҵԭ�ϡ�
��1�����ܱ����ַ��õ�����(AlP)Ƭ������ˮ�����ų�PH3���壬�÷�Ӧ�Ļ�ѧ����ʽΪ ��
��2�����÷�ӦPH3+3HgCl2= P(HgCl)3 +3HCl����ȷ�ⶨ����PH3��
��HgCl2��Һ���������磬˵��HgCl2����________________�����������������������������
��ͨ���ⶨ��Һ____________�仯���ɲⶨһ�����������PH3��Ũ�ȡ�
��3��PH3��һ�ֹ�ҵ�Ʒ��漰������ת����ϵ����ͼ��ʾ�� 
������������________________Ԫ�ᡣ
������ӦI���ɵ�n(NaH2PO2):n(Na2HPO3) =3:1ʱ���μӷ�Ӧ��n(P4)��n(NaOH)= ��
��4��һ�����ڴ���PH3���������ռ��ɷ�Ϊ�������80%����ľм�����ɼ���15%������̿2.5%����ʯ�ۣ�����飩2.5%��
��������ƽ�PH3����ΪH3PO4�Ļ�ѧ����ʽΪ________________��
�������е�ˮ�����ɼӿ�PH3���������̣���ԭ�������____________��
��5���ӣ�4���е����ղ������л����������(CaHPO4)�ķ������£�
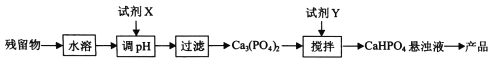
���Լ�xΪ ���ѧʽ����
����֪25��ʱ��H3PO4��Kal=7.5��10-3��Ka2=6.3��10-8��Ka3 =4.4��10-13������Yʱ��Ӧ��������ҺpH 7������>������=������<������ͨ������˵������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧΪ֤�����뱽��������ȡ����Ӧ���Ǽӳɷ�Ӧ�����������ʾ��ʵ��װ��ͼ������AΪһ֧�Թܸ��Ƴɵķ�Ӧ�����������¶˿���һ��С�ף�����ʯ���ޣ��ٷ���������м��
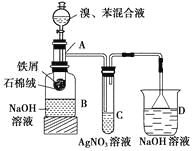
�Իش��������⣺
��1����Ӧ����A����μ�����ͱ��Ļ��Һ���������ھͷ�����Ӧ��д��A����������Ӧ�Ļ�ѧ����ʽ��_________________________(�л���Ҫд�ṹ��ʽ)��
��2����Ӧһ��ʱ�����C�Թ��ڿ�����dz��ɫ�������ɣ���ʱ��ͬѧ�ó�������ķ�Ӧ��ȡ����Ӧ�����Ǽӳɷ�Ӧ�Ľ��ۣ��ý����Ƿ���ȷ��________(������ȷ����������ȷ��)��������__________________��
������ȷ��Ӧ��ζ�װ�ý��иĽ���__________________________________________________��
(���ش�����ȷ�������ʲ��ػش�)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݱ�������300����70MPa���ɶ�����̼�������ϳ��Ҵ��ѳ�Ϊ��ʵ��2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ���������������
CH3CH2OH(g)+3H2O(g) ���������������
A. ʹ��Cu-Zn-Fe�����ɴ���������Ч��
B. ��Ӧ����300�����п��Ʋ�÷�Ӧ�����ȷ�Ӧ
C. �������CO2��������H2��ת����
D. ��ƽ���������з����CH3CH2OH��H2O�����CO2��H2��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ��2CH3COCH3(l)![]() CH3COCH2COH(CH3)2(l)��ȡ����CH3COCH3���ֱ���0����20�����������ת��������ʱ��仯�Ĺ�ϵ����(Y��t)��ͼ��ʾ������˵����ȷ����
CH3COCH2COH(CH3)2(l)��ȡ����CH3COCH3���ֱ���0����20�����������ת��������ʱ��仯�Ĺ�ϵ����(Y��t)��ͼ��ʾ������˵����ȷ����
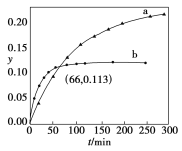
A��b����0����CH3COCH3��Y��t����
B����Ӧ���е�20minĩ��CH3COCH3��![]() >1
>1
C�������¶ȿ����̷�Ӧ��ƽ���ʱ�䲢�����ƽ��ת����
D����Y��0��Y��0.113��CH3COCH2COH(CH3)2��![]() ��1
��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2016�챱������һģ��Cu2O�����������������ᣬijѧϰС��̽���Ʊ�Cu2O�ķ�����
���������ϡ�
�� CuSO4��Na2SO3��Һ��Ͽ��Ʊ�Cu2O��
�� Cu2OΪש��ɫ��������������������Cu2+��Cu��
�� Cu2O��Cu(SO3)23�������ת�� ![]()
��1������0.25 mol��L��1CuSO4��Һ��0.25 mol��L��1 Na2SO3��Һ�����CuSO4��ҺpH=4��Na2SO3��Һ
pH=9�������ӷ���ʽ��ʾCuSO4��ҺpH=4��ԭ��_______��
��2�����CuSO4��Һ��Na2SO3��Һ��Ӧ��Cu2O�����ӷ���ʽ��
![]()
��ʵ��̽����
���� | ���� |
| i �л�ɫ�������������� Na2SO3��Һ�ĵ��룬�������ӣ�������5 mLʱ����Һ����ɫ��ʧ�� ii ���Թܼ��ȣ���ɫ������Ϊש��ɫ���д̼�����ζ��������� iii�ڼ��������£���������Na2SO3��Һ��ש��ɫ�������٣���1�ӵ�10 mLʱ��������ȫ�ܽ⣬����ɫ��Һ�� |
��3��֤��ii��ש��ɫ������Cu2O��ʵ�鷽����_________________��
��4��������i����ɫ��������Cu2SO3��ii�������ɻ�ɫ��ש��ɫ�Ļ�ѧ����ʽ��________________��
��5��iii��ש��ɫ������ʧ��ԭ����_________________��
��6���ڼ���������������2 mL 0.25 mol��L��1Na2SO3��Һ�еμ�0.25 mol��L��1CuSO4��Һ��������Ԥ�ڹ۲쵽��������_________________��
��7��������ʵ��ó����ۣ�CuSO4��Һ��Na2SO3��Һ��Ӧ�Ʊ�Cu2O��Ӧ���Ƶ�������_______��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��5���л���ѧ����]
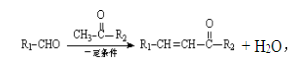
�����㶹����һ����������Ѫ�ܼ�����ҩ����谭Ѫ˨��չ�������㶹�ؿ���ͨ�����·����ϳ�(���ַ�Ӧ����ʡ��)��
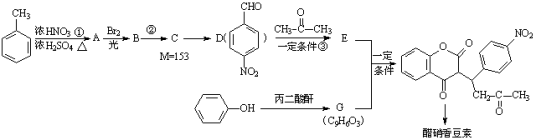
��֪��
�ش���������
��1����Ӧ���ķ�Ӧ������ ����A��B����Ĺ����������� ��
��2����Ӧ���Ļ�ѧ����ʽΪ ��
��3����Ӧ���Ļ�ѧ����ʽΪ ��
��4������E���ʣ�����˵����ȷ���� (����ĸ���)��
a���ں˴Ź������������������շ�
b�����������Ը��������Һ����D��E
c�����Է����ӳɷ�Ӧ���ۺϷ�Ӧ��������Ӧ�ͻ�ԭ��Ӧ
d������˳���칹
��5��д��G�Ľṹ��ʽ ��
��6�����ӽṹ��ֻ����һ��������ͬʱ��������������G��ͬ���칹�干�� �֡�
�������Ȼ�����Һ������ɫ��Ӧ�� ������̼��������Һ��Ӧ���ɶ�����̼���塣
���У������ϵ�һ�ȴ���ֻ�����ֵ�ͬ���칹��Ľṹ��ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˱Ƚ�����ЧӦ�����Ŀǰȫ�����������Ӱ�죬��ѧ��ͨ�����á�����ЧӦָ�������Զ�����̼Ϊ��Ա�����1��(A)��(I)�����������ڴ����е�����ٷֱȼ�������ЧӦָ������ϱ����г��ľ������壬�Բ���ش����и��⣺
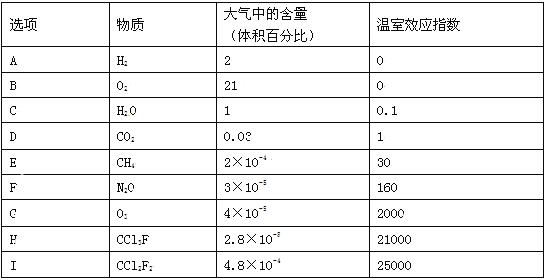
��1�������ɼ��Լ��γɵļ��Է����� ��
A��N2 B��O2 C��H2O D��CO2 E��CH4
��2������˵������ȷ���� ��
A��N2O��CO2��CCl3F��CCl2F2��Ϊ�ȵ�����
B��CCl2F2��ͬ���칹�壬˵������̼ԭ�Ӳ���sp3��ʽ�ӻ�
C��CH4��Ŀǰ��������ЧӦ����Ҫԭ��
D��H2O�е��Ǿ�����������ߵģ�����Ϊˮ���Ӽ����γ����
��3���ڰ뵼��������������ʹ���У����������ɢ�����磺NF3��CHClFCF3��C3F8�������������ģ���Щȷ��ǿ�������壬�����Ʋⲻ��ȷ���� ��
A���ɼ۲���ӶԻ������ۿ�ȷ��NF3���ӳ�������
B��C3F8��CCl4�е��ܽ�ȱ�ˮ�д�
C��CHClFCF3���������칹
D����һ�����ܣ�N��O��F
��4�����龧��ľ����ṹ��ͼ,�����й�˵����ȷ���� ��
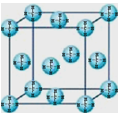
A�������ڳ����³���̬,˵�����龧�����ڷ��Ӿ���
B��������1��CH4������12�����ڵļ������
C�� CH4�����ۻ�ʱ��˷����ۼ�
D����ȼ��(8CH4��46H2O)���ڵ��¸�ѹ���γɵľ���
��5�����������ڻ�̬ʱ��������Ų�ʽΪ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�γ�����л�����������������������Ŀ�ѧ�Ҽ����Ƴɵ��������� ��
A���ſ����ƾ� B��ά�գ�����
C�������գ��� D��ŵ��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com