
【题目】根据下面的反应路线及所给信息填空。
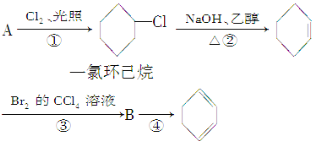
(1)A的结构简式是______,名称是______。
(2)①的反应类型是______,②的反应类型是______。
(3)反应④的化学方程式是__________________________________
【答案】![]() 环己烷 取代反应 消去反应
环己烷 取代反应 消去反应 ![]()
【解析】
(1)由反应①可知,A与氯气在光照的条件下发生取代反应生成一氯环己烷,故A为![]() ;
;
(2)反应①环己烷中H原子被氯原子取代生成一氯环己烷;由转化关系可知,反应②由一氯环己烷去掉HCl生成环己烯;
(3)由合成路线可知,B为1,2﹣二溴环己烷,故反应④是1,2﹣二溴环己烷发生消去反应生成1,4﹣环己二烯。
(1)由反应①可知,A与氯气在光照的条件下发生取代反应生成一氯环己烷,故A为![]() ,名称为:环己烷;
,名称为:环己烷;
(2)反应①环己烷中H原子被氯原子取代生成一氯环己烷,该反应为取代反应;由转化关系可知,反应②由一氯环己烷去掉HCl生成环己烯,该反应属于消去反应;
(3)由合成路线可知,B为1,2﹣二溴环己烷,故反应④是1,2﹣二溴环己烷发生消去反应生成1,4﹣环己二烯,反应条件为氢氧化钠醇溶液加热,反应方程式为![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
①二氧化硅可与NaOH溶液反应,因此可用NaOH溶液雕刻玻璃;
② 明矾溶于水可水解生成Al(OH)3胶体,因此可以用明矾对自来水进行杀菌消毒;
③ 可用蒸馏法、电渗析法、离子交换法等对海水进行淡化;
④ 从海带中提取碘只需用到蒸馏水、H2O2溶液和四氯化碳三种试剂;
⑤地沟油可用来制肥皂、提取甘油或者生产生物柴油;
⑥石英玻璃、Na2O·CaO·6SiO2、淀粉、氨水的物质类别依次为纯净物、氧化物、混合物、弱电解质。
A. ③⑤⑥ B. ①④⑤ C. 除②外都正确 D. ③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的。结合下列实验装置图回答问题:
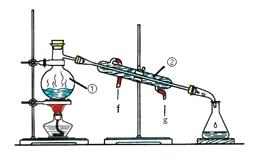
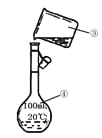
I II
(1)写出上述图中仪器的名称:①_______;②______;
(2)若利用装置I分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物,还缺少的仪器有__________,将仪器补充完整后进行的实验操作的名称为_____;实验时仪器②中冷却水的进口为_______(选填“f”或“g”)。
(3)现需配制250 mL 0.2 mol·L-1 NaCl溶液,装置II是某同学转移溶液的示意图,图中有两处错误分别是_______,_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三聚氰胺(结构简式如图所示)是一种重要的化工原料,可用于阻燃剂、水泥减水剂和高分子合成等领域。一些不法分子却往牛奶中加入三聚氰胺,以提高奶制品的含氮量。下列说法正确的是
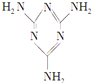
A. 三聚氰胺是一种蛋白质B. 三聚氰胺不是高分子化合物
C. 三聚氰胺分子中含有碳碳双键D. 三聚氰胺的分子式为C3H6N6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是

A. 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-2a kJ·mol-l
2SO3(g) ΔH=-2a kJ·mol-l
C. 该反应中,反应物的总键能小于生成物的总键能
D. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g)![]() 2HI(g) △H=-a kJ·mol-1已知:下列说法正确的是( )
2HI(g) △H=-a kJ·mol-1已知:下列说法正确的是( )

A.H2、I2和HI分子中的化学键都是非极性共价键
B.相同条件下,1 mol H2(g)和1 mol I2(g)的总能量小于2 mol HI(g)的总能量
C.断开2 mol HI分子中的化学键所需能量约为(c+b+a)kJ
D.向密闭容器中加入2 mol H2(g)和2 mol I2(g),充分反应后放出的热量为2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知部分弱酸的电离常数如下表:

下列叙述正确的是
A. 氢氟酸与NaClO溶液混合能够发生反应:HF+NaClO=HClO+NaF
B. 物质的量浓度相同的①NaF②Na2CO3③NaClO三种溶液的pH:③>②>①
C. Na2CO3溶液不能与次氯酸发生反应
D. 少量CO2通入NaClO溶液中的离子反应:CO2+H2O+2ClO-= CO32-+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产C1O2的工艺主要包括:①粗盐精制;②电解微酸性NaC1溶液;③C1O2的制取。工艺流程如下图:
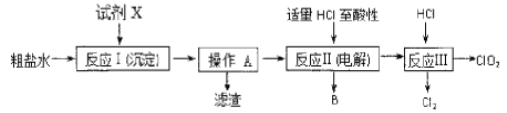
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液
(1)粗食盐水中含有Ca2+、Mg2+、![]() 等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,选出试剂X所代表的试剂,按滴加顺序依次为是__________________________(填化学式)。
等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,选出试剂X所代表的试剂,按滴加顺序依次为是__________________________(填化学式)。
(2)上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成C1O2。反应Ⅲ的化学方程式为______________。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知ClO2+I-+H+==I2+Cl-+H2O未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。(已知:![]() )
)
①准确量取10.00 mL ClO2溶液的玻璃仪器是__________________。
②上述步骤3中滴定终点的现象是__________________________。
③若实验中使用的Na2S2O3标准溶液部分因被氧气氧化而变质,则实验结果_________(填“偏高”、“偏低”或“无影响”)
④根据上述步骤可计算出原C1O2溶液的浓度为_________mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反-10-羟基-2-癸烯酸(HO![]() COOH)简称10-HDA,在自然界只存在于蜂王浆中,所以也称为王浆酸,有很好的杀菌、抑菌作用和抗癌、抗辐射的功能。王浆酸的一种人工合成路线设计如下:
COOH)简称10-HDA,在自然界只存在于蜂王浆中,所以也称为王浆酸,有很好的杀菌、抑菌作用和抗癌、抗辐射的功能。王浆酸的一种人工合成路线设计如下:
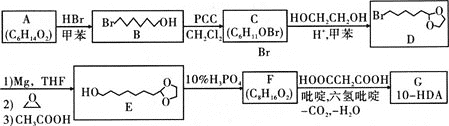
已知:1mol A与足量金属钠反应生成1mol H2;C、F都能发生银镜反应
回答下列问题:
(1)A的化学名称为________;A生成B的反应类型为________;D的分子式为________;F的结构简式为________。
(2)若用金属铜催化氧化B生成C,其化学方程式为________。
(3)由C→D、E→F的转化,可推断此设计的目的是________。
(4)G的同分异构体中能同时满足下列条件的共有________种(不考虑立体异构);
①能与饱和碳酸氢钠溶液反应产生气体
②含六元环醚结构和正丁基(-CH2CH2CH2CH3)
其中核磁共振氢谱显示为7组峰的是________(写结构简式)。
(5)G与酸或醇都能发生酯化反应。酸催化下酯化反应的历程可表示为(箭头表示原子或电子的迁移方向):
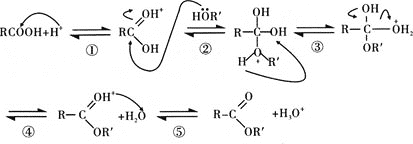
据此完成4-羟基丁酸在酸催化下生成4-羟基丁酸内酯的反应历程:_______
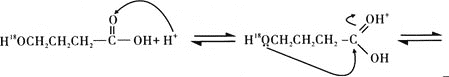
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com