
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是

A. 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-2a kJ·mol-l
2SO3(g) ΔH=-2a kJ·mol-l
C. 该反应中,反应物的总键能小于生成物的总键能
D. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列变化中,吸收的热量用于克服分子间作用力的是( )
A. 加热氯化钠使之熔化 B. 加热二氧化硅使之熔化
C. 液溴受热变成溴蒸气 D. 加热碘化氢使之分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分离提纯是化学实验中的重要部分,方法有过滤、蒸发、萃取、蒸馏等,应用广泛,环己醇脱水是合成环己烯的常用方法,实验室合成环己烯的反应和实验装置如图:
![]()

可能用到的有关数据如下:

Ⅰ.合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
Ⅱ.分离提纯:
反应粗产物倒入分液漏斗中分别用少量5 %碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是__。
(2)加入碎瓷片的作用是__;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是__(填字母)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并__;在本实验分离过程中,产物应该从分液漏斗的__(填“上口倒出”或“下口倒出”)。
(4)分离提纯过程中加入无水氯化钙的目的是__。
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有__(填正确答案标号)。
A.蒸馏烧瓶 B.温度计 C.分液漏斗 D.牛角管 E.锥形瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
K、Fe、Ni均为重要的合金材料,在工业生产、科技、国防领域有着广泛的用途,请回答下列问题:
(1)K元素处于元素周期表的_____ 区,其基态原子中,核外电子占据的电子云轮廓图为球形的能级有______个。
(2)KCl 和NaCl 均为重要的化学试剂,KCl 的熔点低于NaCl的原因为___________。
(3)从原子结构角度分析,Fe3+比Fe2+更稳定的原因是__________。
(4)NiSO4 溶于氨水形成[Ni (NH3)6]SO4。
①写出一种与[Ni(NH3)6]SO4中的阴离子互为等电子体的分子的分子式_________。
②1mol[Ni(NH3)6]SO4中含有σ键的数目为___________。
③NH3 的VSEPR模型为_____ ;中心原子的杂化形式为_____,其杂化轨道的作用为__________。
(5)K、Ni、F三种元素组成的一种晶体的长方体晶胞结构如图所示。若NA为阿伏加德罗常数的值,该晶体的密度ρ=______g/cm3(用代数式表示)。
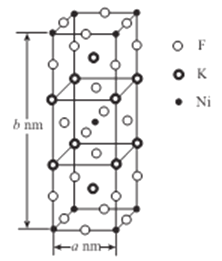
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
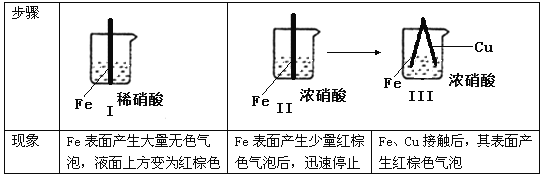
下列说法中不正确的是:
A. Ⅰ种气体有无色变红棕色的化学方程式为:2NO+O2=2NO2
B. Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C6H14有多种同分异构体,则其同分异构体中沸点最高的分子的一氯取代物的种数(不考虑立体异构)是( )
A. 2 B. 3 C. 4 D. 5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用石墨电极电解CuCl2溶液(如图)。
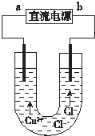
(1)下列分析正确的是_____________________________________________。
A. a端是直流电源的负极
B. 通电使CuCl2发生电离
C. 阳极上发生的反应:Cu2++2e-=Cu
D. 通电一段时间后,在阴极附近观察到黄绿色气体
(2)该同学不慎将一个石墨电极掉入CuCl2溶液中,并未取出,继续用石墨电极电解该溶液,如图所示:
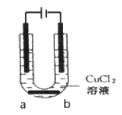
则电解一段时间后,石墨棒a端的现象是___________________________;石墨棒b端的电极反应是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物比卡鲁安(G)可以通过以下方法合成:
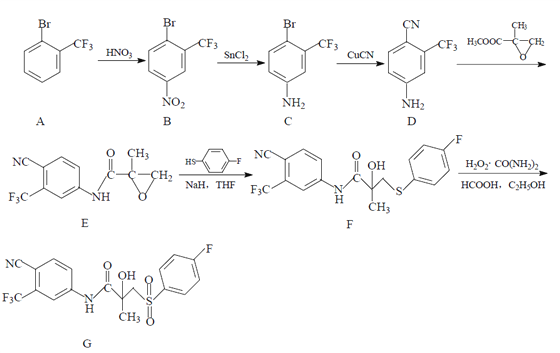
(1)B 中的含氧官能团名称为 _______________ ;
(2)C→D的反应类型为 __________________ ;
(3)写出同时满足下列条件的 D 的一种同分异构体的结构简式:_______________ ;
①有苯环;②能使溴的 CCl4 溶液褪色;③分子中有 2 种不同化学环境的氢
(4)合成 F 时还可能生成一种副产物 X,X 的结构简式为 _________________ ;
(5)已知 : 苯胺 (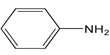 ) 易被氧化,请以甲苯和甲醇为原料制备
) 易被氧化,请以甲苯和甲醇为原料制备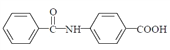 。________________
。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全。确定分解产物的成分。

(1)B装置的作用是________________________________。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中定有______气体产生,写出D中发生反应的离子方程式____________________。若去掉C,是否能得出同样结论并解释其原因__________________________。
(3)A中固体分解后产生NH3,写出其两种用途________________________________________。
(4)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3而不含FeO。请完成表内容。(试剂,仪器自选)
实验步骤 | 预期现象 | 结论 |
①取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解; ②______________________________________________________ | 固体残留物仅为Fe2O3 |
(5) 用实验的方法验证C溶液含有NH4+___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com