
【题目】将少量饱和FeCl3溶液分别滴加到下列物质中,得到三种分散系,完成相关问题:
甲:饱和FeCl3溶液滴加到冷水中;
乙:饱和FeCl3溶液滴加到NaOH溶液中;
丙:饱和FeCl3溶液滴加到沸水中。
(1)将丙继续加热煮沸得到红褐色透明液体,反应的化学方程式为____________________。
(2)用最简单的方法判断丙中是否成功制备胶体,请写出相关的操作、现象和结论____________________________________________________________。
(3)向经过检验后的丙中逐滴加入稀盐酸,会出现一系列变化:
①先出现和乙中相同的现象,原因为________________________。
②随后发生变化得到和甲相同的溶液,此反应的离子反应方程式为____________________。
(4)向丙中加入电极通电后,Fe(OH)3胶体粒子移向_______极;(填“阴极”或“阳极”)
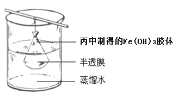
(5)可用如图所示的装置除去Fe(OH)3胶体中的杂质离子来提纯Fe(OH)3胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入AgNO3溶液,若____________________(填实验现象),则说明该Fe(OH)3胶体中的杂质离子已经完全除去。
【答案】FeCl3+3H2O![]() Fe(OH)3( 胶体)+3HCl 强光照射,若有光亮的“通路”则已经制备成功 由于Fe(OH)3胶体遇到电解质会发生聚沉,因而形成红褐色沉淀 Fe(OH)3 +3H+ =Fe3++3H2O 阴 不出现白色沉淀
Fe(OH)3( 胶体)+3HCl 强光照射,若有光亮的“通路”则已经制备成功 由于Fe(OH)3胶体遇到电解质会发生聚沉,因而形成红褐色沉淀 Fe(OH)3 +3H+ =Fe3++3H2O 阴 不出现白色沉淀
【解析】
(1)饱和FeCl3溶液滴加到沸水中,继续加热煮沸得到红褐色透明液体为氢氧化铁胶体,反应的化学方程式为:FeCl3+3H2O![]() Fe(OH)3( 胶体)+3HCl;综上所述,本题答案是:FeCl3+3H2O
Fe(OH)3( 胶体)+3HCl;综上所述,本题答案是:FeCl3+3H2O![]() Fe(OH)3( 胶体)+3HCl。
Fe(OH)3( 胶体)+3HCl。
(2)胶体具有丁达尔效应,因此判断丙中是否成功制备胶体的操作是用强光照射,若有光亮的“通路”则已经制备成功;综上所述,本题答案是:强光照射,若有光亮的“通路”则已经制备成功。
(3)①由于Fe(OH)3胶体遇到电解质会发生聚沉,因而形成红褐色沉淀;
②氢氧化铁能与盐酸发生反应生成氯化铁和水,沉淀溶解,此反应的离子反应方程式为Fe(OH)3 +3H+ =Fe3++3H2O;
综上所述,本题答案是:由于Fe(OH)3胶体遇到电解质会发生聚沉,因而形成红褐色沉淀;Fe(OH)3 +3H+ =Fe3++3H2O。
(4)氢氧化铁胶体的胶粒带正电荷,因此向丙中加入电极通电后,Fe(OH)3胶体粒子应该移向阴极;综上所述,本题答案是:阴。
(5)因为银离子与氯离子反应生成白色氯化银沉淀;所以更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入AgNO3溶液,若不出现白色沉淀则说明该Fe(OH)3胶体中的杂质离子已经完全除去;综上所述,本题答案是:不出现白色沉淀。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的“FeSO4”、较多的Cu2+和少量的Na+。为了减少污染变废为宝,工厂计划从该废水中回收硫酸亚铁和铜。根据流程图,完成回收硫酸亚铁和铜的简单实验方案。回答下列问题:

(1)加入原料①为____________;操作②的名称为___________,该操作所用到的玻璃仪器主要有______。
(2)固体A为____________;
(3)写出加入原料①和②有关反应的离子方程式__________________、________________________。
(4)操作③获得FeSO4·7H2O,需要经过_____、_____、过滤等操作。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 标况下11.2L 甲醇所含共价键数为5NA
B. 1L 1mol/L葡萄糖溶液含有氧原子数为6NA
C. 46g乙醇在金属铜催化下完全反应生成乙醛转移电子数为2NA
D. 0.1L 12mol/L 浓硫酸与足量Zn完全反应标况下生成气体1.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向AgCl浊液中滴加氨水后可得到澄清溶液,继续滴加浓硝酸后又有沉淀生成。经查资料得知:Ag++ 2NH3·H2O![]() Ag(NH3)2+ 2H2O。下列分析不正确的是
Ag(NH3)2+ 2H2O。下列分析不正确的是
A. 浊液中存在沉淀溶解平衡:AgCl (s)![]() Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
B. 实验可以证明NH3结合Ag+能力比Cl-强
C. 实验表明实验室可用氨水洗涤银镜反应后的试管
D. 由资料信息可推知:加浓硝酸后生成的沉淀为AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配合物Na2[Fe(CN)5(NO)]可用于离子检验,下列说法不正确的是
A. 此配合物中存在离子键、配位键、极性键、非极性键
B. 配离子为[Fe(CN)5(NO)]2-,中心离子为Fe3+,配位数为6,配位原子有C和N
C. 1mol配合物中σ键数目为12NA
D. 该配合物为离子化合物,易电离,1mol配合物电离共得到3NA阴阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:5HClO2===4ClO2↑+H++Cl-+2H2O。(HClO2为弱酸)向NaClO2溶液中滴加H2SO4,开始时HClO2分解反应缓慢,随后反应迅速加快,其原因是
A. 溶液中的Cl-起催化作用 B. 溶液中的H+起催化作用
C. ClO2逸出,使反应的生成物浓度降低 D. 在酸性条件下,亚氯酸钠的氧化性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列4种物质:①Na2O2、②SiO2、③SO2、④NaHCO3固体。其中,
(1)与水反应,生成能使带火星木条复燃的固体是________(填序号);
(2)能使品红溶液褪色且加热时又复原的是_________(填序号);
(3)上述物质中有1种物质难溶于水,该物质在一定条件下与焦炭发生反应,可制得电脑芯片以及太阳能电池的材料,该反应的化学方程式为:_______________________________;
(4)上述物质中有1种物质可以用来除去多余的胃酸,它还是常见的疏松剂,主要是因为它在加热条件下产生了气体,使食品变疏松。写出其受热分解的化学方程式___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com