
【题目】某工厂的工业废水中含有大量的“FeSO4”、较多的Cu2+和少量的Na+。为了减少污染变废为宝,工厂计划从该废水中回收硫酸亚铁和铜。根据流程图,完成回收硫酸亚铁和铜的简单实验方案。回答下列问题:

(1)加入原料①为____________;操作②的名称为___________,该操作所用到的玻璃仪器主要有______。
(2)固体A为____________;
(3)写出加入原料①和②有关反应的离子方程式__________________、________________________。
(4)操作③获得FeSO4·7H2O,需要经过_____、_____、过滤等操作。
【答案】Fe(或铁粉) 过滤 漏斗、玻璃棒、烧杯 Fe和Cu Fe+Cu2+=Fe2++Cu Fe+2H+=Fe2++H2↑ 蒸发浓缩 冷却结晶
【解析】
工业废水中含有大量的FeSO4、Cu2+和少量的Na+,从该废水中回收硫酸亚铁和铜,可用单质铁置换出铜,则结合流程可知原料①为Fe,操作①为过滤,所得固体为铁和铜,原料②为稀硫酸溶解金属铁,然后过滤得到铜和硫酸亚铁溶液,将二次的滤液合并得到硫酸亚铁溶液,然后通过操作③蒸发浓缩、冷却结晶、过滤,可得到FeSO4![]() 7H2O,以此来解答。
7H2O,以此来解答。
(1)工业废水中含有大量的FeSO4、Cu2+和少量的Na+,根据流程图中可以知道,完成回收硫酸亚铁和铜,先加过量铁粉把铜置换出来,Fe+Cu2+=Fe2++Cu,过滤,废水中剩下FeSO4和少量的Na+,铁粉、铜中加H2SO4得到FeSO4,原料①的试剂为Fe,操作②为过滤,过滤所需要的仪器为漏斗、玻璃棒、烧杯,
故答案为:Fe;过滤;漏斗、玻璃棒、烧杯;
(2)根据以上分析固体A是Fe和Cu,
故答案为:Fe和Cu;
(3)加入Fe后发生的离子方程式为Fe+Cu2+=Fe2++Cu;加入H2SO4后发生的离子方程式Fe+2H+= Fe2++H2↑;
故答案为:Fe+Cu2+=Fe2++Cu;Fe+2H+= Fe2++H2↑。
(4)根据流程图中可以知道,操作Ⅰ加铁粉,Fe+Cu2+=Fe2++Cu,过滤,废水E中剩下FeSO4和少量的Na+,加入C中的B为H2SO4,因为铁粉、铜中加入适量稀硫酸,稀硫酸和铁粉反应,生成硫酸亚铁,分离不溶于水的固体和液体,用过滤,回收硫酸亚铁,需采用蒸发浓缩、冷却结晶、过滤等操作,
故答案为:蒸发浓缩 ;冷却结晶。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】用无水 Na2SO3固体配制 250 mL 0.1000 mol·L-1 溶液的步骤如下图,请回答:
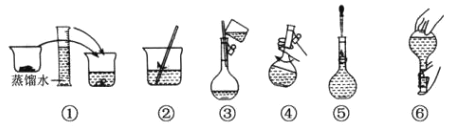
(1)在配制过程中必要的仪器有:烧杯、玻璃棒、胶头滴管、 250ml 容量瓶和____________;检验容量瓶是否漏水的操作方法是____________________________________。
(2)下列操作不会对所配的Na2SO3溶液浓度产生误差的是__________。
A.容量瓶刚用蒸馏水洗净,没有烘干
B.图③没有用蒸馏水洗烧杯 2-3 次,并转移洗液
C.图⑤时仰视容量瓶的刻度线
D.图⑥后,发现液面略低于刻度线,再滴加少量水使液面凹面与刻度线相切
(3)已知亚硫酸钠在空气中能被氧气氧化生成硫酸钠,请设计实验检验配制的 Na2SO3 溶液是否发生变质_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是( )
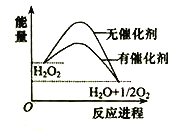
A. 加入催化剂,减小了反应的热效应
B. 加入催化剂,可提高H2O2的平衡转化率
C. H2O2分解的热化学方程式:H2O2 → H2O + O2 + Q
D. 反应物的总能量高于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有73gHCl气体,计算:
(1)该气体为___ mol。
(2)该气体所含分子数为_________个。
(3)该气体在标准状况下的体积为___ L。
(4)将该气体溶于水配成2L溶液,其物质的量浓度为_______mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨及其相关工业中,部分物质间的转化关系如下:

下列说法不正确的是( )
A. 反应Ⅰ、Ⅱ、Ⅲ、Ⅳ均属于氧化还原反应
B. 上述转化中包含了氨气、硝酸、硝铵、小苏打、纯碱的工业生产方法
C. 反应Ⅳ和Ⅵ中的部分产物可在上述流程中循环利用
D. 反应V是先向饱和氯化钠溶液中通CO2至饱和再通NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如右图所示,下列说法正确的是

A. 腐蚀过程中,负极是C
B. Fe失去电子经电解质溶液转移给C
C. 正极的电极反应式为4OH―-4e-==2H2O+O2↑
D. 每生成1mol铁锈(Fe2O3·xH2O)理论上消耗标准状况下的O233.6L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修5:有机化学基础]
亲水型功能高分子M和香料N可由如图所示途径合成(部分产物略去):

已知:
①A是芳香烃的含氧衍生物,相对分子质量为108
②有机物分子中,同一个碳原子上连接有两个羟基时不稳定,会自动脱水
(S)R1CHO + R2CH2CHO![]() R1CH=
R1CH=![]() +H2O
+H2O
请回答下列问题:
(1)E的化学名称_______,C的结构简式 _______;
(2) M中的含氧官能团的名称为_______,A生成B的反应类型________;
(3)写出F到G的第一步化学方程式______________;
(4)同时满足下列条件的G的同分异构体有____种(不考虑立体异构,不计G本身)
①苯环上有四种不同的氢
②能与NaHCO3溶液反应产生气体
③遇氯化铁溶液会显色
④分子中只存在一个环
(5)仿照题中的合成线路图,以乙醇为起始物,无机试剂任选,写出合成聚-2-丁烯醛的线路图:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是

A.含16 g氧原子的二氧化硅晶体中含有的δ键数目为2NA
B.23.4 g NaCl晶体中含有0.1NA个如图所示的结构单元
C.常温常压下,5 g D2O含有的质子数、电子数、中子数均为2.5NA
D.2 mol SO2和1 mol O2在一定条件下反应所得混合气体分子数小于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将少量饱和FeCl3溶液分别滴加到下列物质中,得到三种分散系,完成相关问题:
甲:饱和FeCl3溶液滴加到冷水中;
乙:饱和FeCl3溶液滴加到NaOH溶液中;
丙:饱和FeCl3溶液滴加到沸水中。
(1)将丙继续加热煮沸得到红褐色透明液体,反应的化学方程式为____________________。
(2)用最简单的方法判断丙中是否成功制备胶体,请写出相关的操作、现象和结论____________________________________________________________。
(3)向经过检验后的丙中逐滴加入稀盐酸,会出现一系列变化:
①先出现和乙中相同的现象,原因为________________________。
②随后发生变化得到和甲相同的溶液,此反应的离子反应方程式为____________________。
(4)向丙中加入电极通电后,Fe(OH)3胶体粒子移向_______极;(填“阴极”或“阳极”)
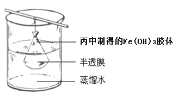
(5)可用如图所示的装置除去Fe(OH)3胶体中的杂质离子来提纯Fe(OH)3胶体,实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入AgNO3溶液,若____________________(填实验现象),则说明该Fe(OH)3胶体中的杂质离子已经完全除去。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com