
【题目】下列实验装置不能达到实验目的是
A.  配置稀硫酸溶液 B.
配置稀硫酸溶液 B. 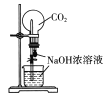 用CO2做喷泉实验
用CO2做喷泉实验
C. 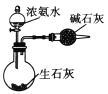 制取干燥纯净的氨气 D.
制取干燥纯净的氨气 D.  比较碳酸钠和碳酸氢钠稳定性
比较碳酸钠和碳酸氢钠稳定性
科目:高中化学 来源: 题型:
【题目】在硫酸工业中,通过下列反应使SO2氧化成SO3:2SO2(g)+O2(g) ![]() 2SO3(g)ΔH=-198kJ·mol-1。下表为不同温度和压强下SO2的转化率(%)
2SO3(g)ΔH=-198kJ·mol-1。下表为不同温度和压强下SO2的转化率(%)
| 1×105 | 5×105 | 1×106 | 5×106 | 1×107 |
450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
(1)实际生产中,选定400~500℃作为操作温度,其原因是_______________________。
(2)实际生产中,采用的压强为常压,其原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中均为化合物的一组是
A.金刚石、干冰、SO2
B.KCl、盐酸、NaOH
C.CuSO4·5H2O、冰、AgCl
D.液氨、CaCO3、铝合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.下列有关说法正确的是( )
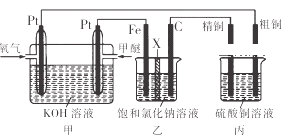
A. 反应一段时间后,乙装置中生成的氢氧化钠在铁极区
B. 乙装置中铁电极为阴极,电极反应式为Fe﹣2e ﹣=Fe2+
C. 通入氧气的一极为正极,发生的电极反应为O2﹣4e ﹣+2H2O═4OH﹣
D. 反应一段时间后,丙装置中硫酸铜溶液浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气在氯气中燃烧生成氯化氢,同时产生苍白色火焰,下列说法正确的是( )
A. 该反应是放热反应B. 该反应是吸热反应
C. 断裂H-H键放出热量D. 形成H-Cl键吸收热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种难溶金属硫化物的溶度积常数(25℃):
化学式 | FeS | CuS | MnS |
溶度积 | 6.3×10﹣18 | 1.3×10﹣36 | 2.5×10﹣13 |
下列有关说法中正确的是( )
A. 25℃时,CuS的溶解度大于MnS的溶解度
B. 25℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10﹣36 molL﹣1
C. 因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+H2SO4不能发生
D. 除去某溶液中的Cu2+,可以选用FeS作沉淀剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓硫酸试剂瓶标签上的有关数据,根据标签上的数据回答下列问题:

(1)取任意体积的该浓硫酸时,下列物理量会随所取体积的多少而发生变化的是________(选填相应字母编号)
A.溶液密度 B.溶液的物质的量浓度
C.溶液的质量分数 D.溶质的物质的量
(2)某学生欲用上述浓硫酸和蒸馏水配制450mL物质的量浓度为1.0mol·L-1的稀硫酸。
①该学生需要用量筒量取________mL上述浓硫酸进行配制。
②该实验中除了量筒、玻璃棒和烧杯外,还缺少的玻璃仪器有_________。
③在配制过程中,下列实验操作对所配制的稀硫酸的物质的量浓度有何影响?(在后面横线选择填写相应字母标号A、偏高;B、偏低;C、无影响)
I、用量筒量取浓硫酸时仰视凹液面读数_________
II、转移时容量瓶中已经有少量蒸馏水________
Ⅲ、定容时仰视刻度线__________
Ⅳ、定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯化氢极易溶于水,标准状况下,1体积的水可以溶解500体积的氯化氢(HCl)气体,氯化氢的水溶液即为盐酸。
实验室现有质量分数为36.5%、密度为1.19gcm﹣3的浓盐酸,若用该浓盐酸配制0.4molL﹣1的稀盐酸220mL,试回答下列问题:
(1)配制该稀盐酸时,应选用的容量瓶的容积为(______).
A. 100mL B. 220mL C. 250mL D. 500mL
(2)计算需要____mL的浓盐酸,
(3)在量取浓盐酸后,进行了下列操作:
①待稀释盐酸的温度与室温一致后,沿玻璃棒注入容量瓶中.
②往容量瓶中加蒸馏水至液面离容量瓶刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切.
③在盛蒸馏水的烧杯中注入盐酸,并用玻璃棒搅动,使其混合均匀.
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶.
上述操作中,正确的顺序是(填序号)_____________。
(4)在下述配制过程中,配制的稀盐酸浓度将会偏高的是_________________;使浓度会偏低的是 _________________________。(填序号)
①未转移溶液前容量瓶中有少量的蒸馏水
②量取浓盐酸时俯视刻度线
③量取浓盐酸后用蒸馏水洗涤量筒
④若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶
⑤定容时俯视刻度线
(5)在标准状况下,用一支收集满HCl气体的试管倒立在水槽中,水倒吸当充满试管时用塞子堵住试管口竖立(假设溶液不泄漏),则该溶液的溶质的物质的量浓度为_________________(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带和海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海洋中提取碘的流程如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ―→
―→![]()
某化学兴趣小组将上述流程②、③设计成如下图所示操作。

已知过程②发生反应的化学方程式为Cl2+2KI===2KCl+I2
回答下列问题:
(1)写出提取过程①、③中实验操作的名称:①____________,③____________。
(2)在灼烧过程中,使用到的实验仪器有酒精灯、____________、____________(除泥三角外)。
(3)F中下层液体的颜色为________色,上层液体中溶质的主要成分为____________。
(4)从F中得到固态碘还需进行的操作是_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com