
根据表中信息回答下列问题。
|
元素 |
Si |
P |
S |
Cl |
|
单质与氢气 反应的条件 |
高温 |
磷蒸气与氢气能反应 |
加热 |
光照或点燃时发生爆炸而化合 |
(1)S在元素周期表中的位置是 。
(2)根据表中信息可知,Si、P、S、Cl 四种元素的的非金属性依次增强。用原子结构解释原因:同周期元素电子层数相同,从左至右, ,原子半径逐渐减小,得电子能力逐渐增强。
(3)25℃时,以上四种元素的单质与氢气反应生成l mol气态氢化物的反应热如下:
a.+34.3 kJ·mol-1 b.+9.3 kJ·mol-1 c.−20.6 kJ·mol-1 d.−92.3 kJ·mol-1
请写出固态白磷(P4)与H2反应生成气态氢化物的热化学方程式 。
(4)探究同主族元素性质的一些共同规律,是学习化学的重要方法之一。已知硒(Se)是人体必需的微量元素,其部分信息如图。
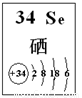
①下列有关说法正确的是 (填字母)。
a. 原子半径:Se>S>P b. 稳定性:H2Se>H2S
c. 因为酸性H2Se<HCl,所以非金属性Se<Cl
d. SeO2是酸性氧化物,能与烧碱溶液反应
②在下表中列出对H2SeO3各种不同化学性质的推测,举例并写出相应的化学方程式。
|
编号 |
性质推测 |
化学方程式 |
|
1 |
氧化性 |
H2SeO3+4HI=Se↓+2I2+3H2O |
|
2 |
|
|
|
3 |
|
|
(1)第3周期VIA(2)核电荷数逐渐增大(或质子数)
(3)P4(s)+6H2(g)=4PH3(g) △H=+37.2 kJ·mol-1
(4)①d
②
|
1 |
性质预测 |
化学方程式 |
|
2 |
还原性 |
H2SeO3+Cl2+H2O= H2SeO4+2HCl |
|
3 |
酸性 |
H2SeO3+2NaOH=Na2 SeO3+2H2O. |
【解析】
试题分析:(1)、(2)参见答案;(3)先写出固态白磷(P4)与H2反应生成气态氢化物的化学方程式:P4+6H2=4PH3,通过化学方程式看以看出,1mol P4与H2反应生成4 mol PH3,根据题设条件,当反应生成4 mol PH3时,则反应放出的热量为:4×+9.3 kJ·mol-1=+37.2 kJ·mol-1 ,所以热化学方程式为:
P4(s)+6H2(g)=4PH3(g) △H=+37.2 kJ·mol-1(4)①a.根据同周期和同主族元素原子半径的递变规律,可知正确关系应为:Se>P>S;错误;b.同主族元素气态氢化物的稳定性自上而下依次减弱,正确的应为: H2Se<H2S ,错误;c.应当为最高价氧化物对应的水化物的酸性,即:H2SeO4<HClO4,则非金属性Se<Cl,错误;d.根据同主族元素的性质的相似性,不难得知d正确。
(4)研究H2SeO3的化学性质可从H2SO3的化学性质进行类推,亚硫酸有还原性,能与氯气发生反应,由此可推断H2SeO3也有还原性,化学方程为: H2SeO3+Cl2+H2O= H2SeO4+2HCl;亚硫酸有酸性,能与碱发生反应:则可类推H2SeO3也由此性质,化学方程式为:H2SeO3+2NaOH=Na2 SeO3+2H2O.
考点:考查元素周期表、元素周期律、原子结构、原子半径的大小比较、热化学方程的书写


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 催化剂 |
| 催化剂 |
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
| 催化剂 |
| 催化剂 |
| A | B |
| ①分子式为C3H8O; ②在Cu的作用下催化氧化的产物 不能发生银镜反应 |
①由C、H两种元素组成; ②球棍模型为:  |
| 浓H2SO4 |
| △ |
| 浓H2SO4 |
| △ |
 +HNO3(浓)
+HNO3(浓)| 浓H2SO4 |
| △ |

 +HNO3(浓)
+HNO3(浓)| 浓H2SO4 |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | E |
| ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与水在一定条件下反应生成C |
①由C、H两种元素组成; ②球棍模型为:  |
①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯. |
①相对分子质量比C少2; ②能由C氧化而成; |
①由C、H、O三种元素组成; ②球棍模型为:  |


| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B |
| ①能使溴的四氯化碳溶液退色 ②比例模型为:  ③能与水在一定条件下反应生成醇 |
①由C、H两种元素组成 ②球棍模型为:  |
| 一定条件下 |

| 一定条件下 |

| 浓H2SO4 |
| △ |
| 浓H2SO4 |
| △ |
| 浓H2SO4 |
| 140℃ |
| 浓H2SO4 |
| 140℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B |
| ①能使溴的四氯化碳溶液褪色 ②分子比例模型为  ③能与水在一定条件下反应 |
①由C、H两种元素组成 ②分子球棍模型为  |


查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C |
| 性质结构信息 | 单质在氯气中燃烧火焰呈黄色并产生大量白烟,所得产物的阳离子与D的阳离子电子数相同. | 单质是带有金属光泽的灰黑色固体,是信息技术的关键材料. | 最高价氧化物的水化物与其气态氢化物反应得到离子化合物D. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com