
【题目】若用AG表示溶液的酸度,表达式为:AG=lg![]() 。室温下,用0.1mol·L-1的NaOH溶液滴定10mL 0.1mol·L-1HA溶液,滴定曲线如图所示。下列说法错误的是
。室温下,用0.1mol·L-1的NaOH溶液滴定10mL 0.1mol·L-1HA溶液,滴定曲线如图所示。下列说法错误的是

A. 室温下,该HA的电离平衡常数约为10-5
B. C点时加入NaOH溶液的体积为10mL
C. 滴定过程中从A到D点溶液中水的电离程度先增大后减小
D. 若B点加入的NaOH溶液体积为5mL,所得溶液中c(A-)+2c(OH-)=c(HA)+2c(H+)
【答案】B
【解析】若用AG表示溶液的酸度,表达式为:AG=lg![]() 。室温下,用0.1mol·L-1的NaOH溶液滴定10mL 0.1mol·L-1HA溶液,滴定曲线如图所示。下列说法错误的是
。室温下,用0.1mol·L-1的NaOH溶液滴定10mL 0.1mol·L-1HA溶液,滴定曲线如图所示。下列说法错误的是

A.室温下, 0.1mol·L-1HA溶液中AG=lg![]() 8,则c(H+)=10-3mol/L,该HA的电离平衡常数约为
8,则c(H+)=10-3mol/L,该HA的电离平衡常数约为![]() =
=![]() =10-5,故A正确;B.C点时加入NaOH溶液的体积若为10mL,则恰好溶质NaA,因A-的水解溶液应碱性,AG不可能为0,故B错误;C.A点为HA的酸溶液抑制水的电离,滴定过程中生成NaA,A-的水解促进水的电离,当完全中和后继续滴中的NaOH抑制水的电离,则从A到D点溶液中水的电离程度先增大后减小,故C正确;D.若B点加入的NaOH溶液体积为5mL,此时溶液中HA、NaH等物质的量浓度,存在的电荷守恒式为c(A-)+c(OH-)=c(Na+)+c(H+),物料守恒式为2c(Na+)=c(A-)+c(HA),物料守恒式代入电荷守恒式得c(A-)+2c(OH-)=c(HA)+2c(H+),故D正确;答案为B。
=10-5,故A正确;B.C点时加入NaOH溶液的体积若为10mL,则恰好溶质NaA,因A-的水解溶液应碱性,AG不可能为0,故B错误;C.A点为HA的酸溶液抑制水的电离,滴定过程中生成NaA,A-的水解促进水的电离,当完全中和后继续滴中的NaOH抑制水的电离,则从A到D点溶液中水的电离程度先增大后减小,故C正确;D.若B点加入的NaOH溶液体积为5mL,此时溶液中HA、NaH等物质的量浓度,存在的电荷守恒式为c(A-)+c(OH-)=c(Na+)+c(H+),物料守恒式为2c(Na+)=c(A-)+c(HA),物料守恒式代入电荷守恒式得c(A-)+2c(OH-)=c(HA)+2c(H+),故D正确;答案为B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质性质、用途的说法都正确的是
A. 硅晶体是良好的半导体,可用于制造光导纤维
B. 高压钠灯发出的黄光透雾能力强,可用于道路和广场照明
C. 生石灰能与水反应,可用于除去CO2气体中少量的水蒸气
D. 碳酸钠具有碱性,可用于治胃酸中和剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)又称水合联氨,其纯净物为无色透明的油状液体,具有强碱性和吸湿性。将水合肼通入CuO胶体中,可发生如图所示的转化。

(1)图示的转化中,②属于_____________(填“非氧化还原反应”或“氧化还原反应”)。
(2)转化①中,氧化剂与还原剂的物质的量之比为4: l ,则X的化学式为_____。
(3)转化②中,反应一段时间后,溶液中n(OH-)____________(填“增大”“ 减小” 或“不变”)。
(4)若①中参加反应的CuO物质的量为0.4mol,按图示转化过程进行后,④中生成的CuO物质的量也等于0.4mol,则③中参加反应的O2的物质的量与④中今加反应的NaClO的物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的用途不合理的是
A. SiO2可用于制造光导纤维 B. 活性炭可用作除味剂
C. 浓硫酸可用于干燥碱性物质 D. NH4Cl可用作氮肥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用原电池原理除去废水中的乙酸钠和对氯酚(![]() ),其原理如图所示,下列说法不正确的是
),其原理如图所示,下列说法不正确的是

A. 电流方向从A极沿导线流向B极
B. 每转移2mole-,有0.25mol CH3COO-被氧化
C. 当外电路中有2mole-转移时,进入A极区的H+的个数为2NA
D. A极的电极反应式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体育竞技中服用兴奋剂既有失公平,也败坏了体育道德,以下是其中检测出的两种兴奋剂的结构:
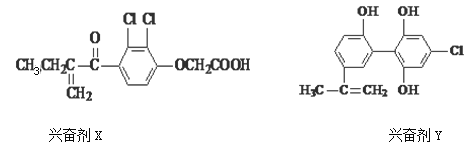
关于它们的说法中错误的是
A.Y遇到氯化铁溶液时显紫色,Y能使溴的四氯化碳溶液褪色
B.X的分子式为:C13H12O4Cl2
C.1molX与足量氢气反应,最多可消耗5molH2
D.1个Y分子中最多有8个碳原子共面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是重要的非金属元素,可以形成多种化合物。回答以下问题:
(1)基态氮原子的电子排布式是________________。C、N、O三种元素第一电离能从大到小的顺序是____________________。
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是________________________;N2H4分子中氮原子轨道的杂化类型是____________________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(1)+2N2H4(1)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1
若该反应中有4molN-H键断裂,则形成的π键有_________mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在__________(填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
(3)(CH3)3NH+和AlCl4-形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂___________(填“大”或“小”),可用作____________(填代号)。
a.助燃剂 b.“绿色”溶剂
c.复合材料 d.绝热材料
(4)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的元素符号是___________,与同一个N3-相连的X+有_________个。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)写出在酸催化下,等物质的量的甲醛和苯酚反应生成邻羟甲基苯酚的化学方程式___________________
(2)苯的同系物A,分子中共含66个电子,A苯环上一溴代物只有一种,请写出A的结构简式________________________________
(3)在加热的条件下,乳酸[CH3CH(OH)COOH)]与浓硫酸反应可以使其手性碳原子失去手性。写出该反应的化学方程式____________________________________________________
(4)有一种二肽的化学式是C8H14N2O5,发生水解反应后得到α-氨基丙酸和另一种氨基酸X,X的化学式为________________________________________________
(5)CH3CH(C2H5)CH2CH(C2H5)CH3可由单烯烃与H2加成得到,该单烯烃可能有_______种结构(不考虑立体异构)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com