
摩尔盐[xFeSO4·y(NH4)2SO4·zH2O]是一种重要化工原料。其组成可通过下列实验测定:
①称取1.5680 g样品,准确配成100 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固体0.4660 g。
③再量取25.00 mL溶液A,滴加适量稀硫酸,用0.0200 mol·L-1KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液10.00 mL。
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1. 0×10-5mol·L-1,应保持溶液中c(Ba2+)
≥ mol·L-1。
(2)③中发生反应的离子方程式为 ,滴定终点的现象是 。
(3)通过计算确定样品的组成(必须写出计算过程)。
(1)1.1×10-5 (2分)
(2)MnO4-+5 Fe2++8H+=Mn2++5 Fe3++4H2O(2分)
溶液由无色变为浅紫色(紫色、紫红色),且半分钟不褪色 (1分)
(3)n(SO42-)= n(BaSO4)=0. 466g/233g·mol-1=2. 00×10-3 mol (或2.00mmol) (2分)
n(Fe2+)=5×0. 02000 mol·L-1×10. 00 mL/1000 mL·L-1=1. 000×10-3mol (1分)
n(NH4+)=2×2. 00×10-3 mol-2×1. 000×10-3mol=2. 000×10-3mol (1分)
n(H2O)=(1.5680 g×25.00 mL/100.00mL-1.000×10-3mol
×152g·mol-1-1.000×10-3mol×132g·mol-1)/18 g·mol-1
=6. 000×10-3mol (2分)
x∶y∶z=n(FeSO4)∶n[ (NH4)2SO4]∶n(H2O)=1∶1∶6
该摩尔盐的化学式为FeSO4·(NH4)2SO4·6H2O (1分)
解析试题分析:本题是测定物质组成的计算题。
(1)Ksp= c(Ba2+) × c(SO42-)=1.1×10-10 c(Ba2+)= 1.1×10-5 mol·L-1
(3)在步骤②中得到的白色固体为BaSO4,由此计算出SO42-的含量;在步骤③中根据反应方程式计算出溶液中含有的Fe2+的含量,再根据电荷守恒计算出溶液中含有NH4+的含量。但要注意所取的溶液只是原溶液的1/5,计算原溶液中SO42-和Fe2+的物质的量。最后根据总质量计算水的含量,确定组成。
考点:考查工业测定物质组成中的有关实验操作、计算等内容。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:填空题
结合下表回答下列问题(均为常温下的数据):
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
| HClO | 3×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(22分)研究碳及其化合物的性质和用途是中学化学的任务之一。
I.某兴趣小组在实验室中制备碳酸钠溶液。方案如下:步骤一,取25 mL一定浓度的NaOH溶液,通人CO2气体至过量;步骤二,加热煮沸步骤一所得溶液;步骤三,另取25 mL相同浓度的NaOH溶液与步骤二所得溶液混合,即得碳酸钠溶液。
(1)完成步骤一可选的化学试剂有:稀盐酸、NaOH溶液、大理石、饱和碳酸钠溶液、稀硫酸、饱和碳酸氢钠溶液等,需要的装置如下所示。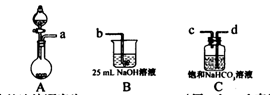
①各装置正确的连接顺序为 (用a、b、c、d表示)。
②检查整套装置气密性的方法是 。
③装置A中常用药品为 ;装置C中化学药品的作用是 。
(2)写出步骤三中发生反应的离子方程式 。
(3)有同学提出“步骤二”没有必要,请你简述自己的看法 。
Ⅱ.实验室用纯碱和盐酸处理某种蛇纹石(已知蛇纹石中含有MgO、SiO2.CaO、Fe2O3、Al2O3等氧化物)模拟制备氧化镁的流程如下: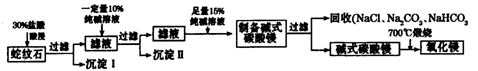
(1)过滤需要的玻璃仪器有 。
(2)沉淀Ⅱ的成分为 ,请用离子方程式表示生成沉淀的过程 (写出一个即可)。
(3)纯碱溶液中所有离子浓度的大小关系为 。
(4)已知l0%的纯碱溶液密度为1.06g/cm3,则其物质的量浓度为____ ,
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(1) 常温下,已知0.1 mol·L-1一元酸HA溶液中c(OH-) / c(H+)=1×10-8。
①常温下,0.1 mol·L-1 HA溶液的pH= ;写出该酸(HA)与NaOH溶液反应的离子方程式: ;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是: 。
(2) 常温下,向pH=a的氨水中加入等体积盐酸时,溶液呈中性,则此盐酸的pH 14-a(>、<、=)
(3) 向物质的量浓度均为0.01mol·L-1的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的离子是 ,当两种难溶电解质共存时,溶液中c(Ba2+)/c(Mn2+) 。(此温度下,Ksp(BaCO3)=8.1×10-9、Ksp(MnCO3)=1.8×10-11)
(4)设Ka、Kh、Kw分别表示CH3COOH的电离平衡常数、CH3COO-的水解平衡常数和水的离子积常数,则三者之间的关系为:
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
在一定温度下,测得0.1 mol·L-1CH3COOH溶液的PH为3.0。则CH3COOH在水中的电离度为 ,此温度CH3COOH的电离平衡常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10—1 | 1.8×10—5 | 4.9×10—10 | K1=4.3×10—7 K2=5.6×10—11 |



查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分)三氯氧磷(化学式:POCl3)常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下: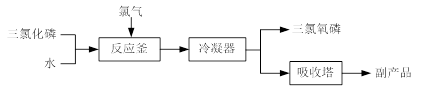
⑴氯化水解法生产三氯氧磷的化学方程式为 。
⑵通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·L-1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是 (选填字母),滴定终点的现象为 。
a.FeCl2 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②实验过程中加入硝基苯的目的是 ,如无此操作所测Cl元素含量将会 (填“偏大”、“偏小”或“不变”)
⑶氯化水解法生产三氯氧磷会产生含磷(主要为H3PO4、H3PO3等)废水。在废水中先加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收。
①在沉淀前先加入适量漂白粉的作用是 。
②下图是不同条件对磷的沉淀回收率的影响图像。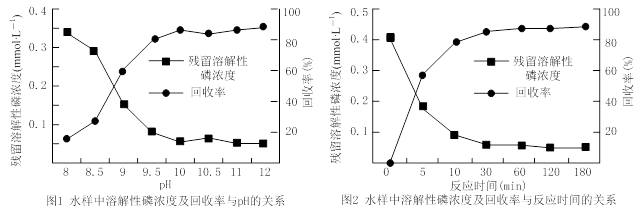
处理该厂废水最合适的工艺条件为 (选填字母)。
a.调节pH=9 b.调节pH=10 c.反应时间30 min d.反应时间120 min
③若处理后的废水中c(PO43-)=4×10-7mol·L-1,溶液中c(Ca2+)= mol·L-1。
(已知Ksp[Ca3(PO4)2]=2×10-29)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。
(1)该实验应选用 作指示剂,量取一定体积的白醋所用的仪器是 。
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL。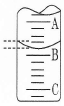
(3)为了减小实验误差,该同学一共进行了3次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为cmo1/L,3次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com