
(1) 常温下,已知0.1 mol·L-1一元酸HA溶液中c(OH-) / c(H+)=1×10-8。
①常温下,0.1 mol·L-1 HA溶液的pH= ;写出该酸(HA)与NaOH溶液反应的离子方程式: ;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是: 。
(2) 常温下,向pH=a的氨水中加入等体积盐酸时,溶液呈中性,则此盐酸的pH 14-a(>、<、=)
(3) 向物质的量浓度均为0.01mol·L-1的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的离子是 ,当两种难溶电解质共存时,溶液中c(Ba2+)/c(Mn2+) 。(此温度下,Ksp(BaCO3)=8.1×10-9、Ksp(MnCO3)=1.8×10-11)
(4)设Ka、Kh、Kw分别表示CH3COOH的电离平衡常数、CH3COO-的水解平衡常数和水的离子积常数,则三者之间的关系为:
(14分)
(1)①3 , HA+OH-=A-+H2O (各2分)
②c(A-)>c(Na+)>c(H+)>c(OH-) (2分)
(2)< (2分)
(3)Mn2+,450 各2分)
(4)Ka·Kh=Kw (2分)
解析试题分析:(1)①c(OH-)/c(H+)=1×10-8,c(OH-)×c(H+)=1×10-14,所以c(OH-)=10-11mol·L-1,则c(H+)=10-3mol·L-1,所以溶液的pH=3;氢离子浓度小于酸的浓度,所以该酸是弱酸,该酸(HA)与NaOH溶液反应的离子方程式为:HA+OH-═A-+H2O.
故答案为:3;HA+OH-═A-+H2O.
②pH=11的NaOH溶液中c(OH-)=10-3mol·L-1,HA是弱酸,酸的浓度远远大于氢离子浓度,所以pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中的溶质是酸和盐,溶液呈酸性,所以溶液中氢离子浓度大于氢氧根离子浓度,酸根离子浓度大于钠离子浓度,溶液中4种离子物质的量浓度大小关系是c(A-)>c(Na+)>c(H+)>c(OH-),
故答案为:c(A-)>c(Na+)>c(H+)>c(OH-).
(2)假设氨水是强电解质时,pH=a的氨水中氢氧根离子浓度=10a-14mol·L-1,向pH=a的氨水中加入等体积盐酸时,溶液呈中性,则氢氧根离子浓度等于氢离子浓度,所以盐酸的pH=14-a;实际上氨水是弱碱,等体积的酸和碱混合后溶液呈中性,说明酸的浓度大于碱的浓度,则盐酸的pH<14-a,故选<.
(3)碳酸钡的溶度积常数等于碳酸锰的溶度积常数,所以锰离子先沉淀;当两种难溶电解质共存时,则
c(CO32-)=c(Mn2+)=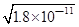 ,溶液中c(Ba2+)=
,溶液中c(Ba2+)= ,c(Ba2+):c(Mn2+)=
,c(Ba2+):c(Mn2+)= :
: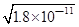 ==450.
==450.
故答案为:Mn2+;450.
(4)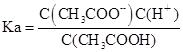 ,
,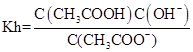 ,Kw=C(H+).C(OH-),所以Ka·Kh=Kw.
,Kw=C(H+).C(OH-),所以Ka·Kh=Kw.
故答案为:Ka·Kh=Kw.
考点:弱电解质在水溶液中的电离平衡;pH的简单计算;酸碱混合时的定性判断及有关ph的计算


科目:高中化学 来源: 题型:填空题
硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4- H++SO42-.
H++SO42-.
请据此回答下列有关问题:
(1)Na2SO4溶液呈 (填“弱酸性”、“中性”或“弱碱性”),原因是: (用离子方程式表示)
(2)写出H2SO4溶液与BaCl2溶液反应的离子方程式: ;
(3)在0.1 mol·L-1的Na2SO4溶液中,下列粒子浓度关系式正确的是 。(填编号)
| A.c(SO42-)+c(HSO4-)=0.1 mol·L-1 | B.c(SO42-)+c(HSO4-)=2 c(Na+) |
| C.c(OH-)=c(H+)+c(HSO4-) | D.c(Na+)+c(H+)=c(OH-)+c(HSO4-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
重铬酸盐广泛用作氧化剂、皮革制作等。以铬矿石(主要成分是Cr2O3,含FeO、Al2O3、 SiO2等杂质)为原料制取重铬酸钠的流程如下:
请回答下列问题:
(1)写出Cr2O3在高温焙烧时反应的化学方程式______________________
(2)写出硫酸酸化使Na-2CrO4转化为Na2Cr2O7的离子方程式 ______________。
(3)某工厂采用石墨电极电解Na2CrO4溶液,实 现了 Na2CrO4到 Na2Cr2O7的转化,其原理如图所示。
①钠离子交换膜的一种材料是聚丙烯酸钠( ),聚丙烯酸钠单体的结构简式是________;
),聚丙烯酸钠单体的结构简式是________;
②写出阳极的电极反应式__________
(4) Na2Cr2O7可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被氧化 所需要O2的质量)。现有某水样100.00 mL,酸化后加入C1 mol/L的Na2Cr2O7溶液 V1 mL,使水中的还原性物质完全被氧化(Cr2O72-还原为Cr3+);再用C2mol/L的FeSO4溶液滴定剩 余的Cr2O72-,结果消耗FeSO4溶液V2 mL。
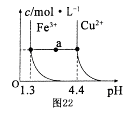
①该水样的COD为______________mg/L;
②假设上述反应后所得溶液中Fe3+和Cr3+的物质的量浓度均为0.1 mol/L,要使Fe3 +沉 淀完全而Cr3+还未开始沉淀.则需调节溶液pH的范围是 _______.
(可能用到的数据:KSPFe(OH)3=4.0×10-38, KSPCr(OH)3=6.0×10-31,
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(15分)
制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ. 向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ. 向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ. 滤液用盐酸调节pH,获得一次精制盐水。
(1)过程Ⅰ除去的离子是______。
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |

查看答案和解析>>
科目:高中化学 来源: 题型:问答题
钠、镁、铁、铜及其化合物在科研和生产生活中有广泛的应用。
(1)Mg—H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,结构如图所示。电池工作时,正极的电极反应式 。常温下,用该电池电解200mL的饱和硫酸铜溶液(电极为惰性电极),反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);当消耗24mg金属Mg,电解后溶液的pH= (不考虑溶液的体积变化)。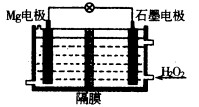
(2)利用电解法在铁制品上镀铜可以防止铁被腐蚀,以下说法正确的是 。
a.电镀时,铜和石墨都可以做阳极,可溶性铜盐作电解质溶液
b.电镀过程中,温度升高,电解反应速率加快
c.电镀过程中,电能全部转化为化学能
d.电镀过程中,铜离子向阴极移动,发生还原反应
(3)NaHS可作为沉淀剂除去溶液中的Cu2+。常温下,NaHS溶液显碱性,原因是 (用离子方程式和必要的文字说明)。向含有Cu2+的废水中加入少量NaHS固体,废水溶液的pH (填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
已知在室温时,Mg(OH)2的溶度积Ksp=5.6×10-12 (mol/L)3,要使0.2mol/lMgSO4溶液中的Mg2+沉淀较为完全[c(Mg2+)<5.6×10-6mol/L],则应向溶液中加入NaOH溶液,使溶液的pH最小为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
摩尔盐[xFeSO4·y(NH4)2SO4·zH2O]是一种重要化工原料。其组成可通过下列实验测定:
①称取1.5680 g样品,准确配成100 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固体0.4660 g。
③再量取25.00 mL溶液A,滴加适量稀硫酸,用0.0200 mol·L-1KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液10.00 mL。
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1. 0×10-5mol·L-1,应保持溶液中c(Ba2+)
≥ mol·L-1。
(2)③中发生反应的离子方程式为 ,滴定终点的现象是 。
(3)通过计算确定样品的组成(必须写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)碘溶于碘化钾溶液中形成I3—,并建立如下平衡:I3— I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
实验原理:
为了测定平衡时的c(I3—) ,可用过量的碘与碘化钾溶液一起摇动,达平衡后取上层清液用标准的Na2S2O3滴定:2 Na2S2O3 + I2 =" 2NaI" + Na2S4O6。
由于溶液中存在I3— I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
实验内容:
1.用一只干燥的100 mL 碘量瓶和一只250 mL碘量瓶,分别标上1、2号,用量筒取80 mL 0.0100 mol.L-1 KI于1号瓶,取200 mL 蒸馏水于2号瓶,并分别加入0.5 g过量的碘。
2.将两只碘量瓶塞好塞子,振荡30分钟,静置。
3.分别取上层清液20 mL用浓度为c mol/L标准Na2S2O3溶液进行滴定。1号瓶消耗V1 mL Na2S2O3溶液,2号瓶消耗V2 mL Na2S2O3溶液。
4.带入数据计算c(I3—)
试回答下列问题
(1)标准Na2S2O3溶液应装入 (填“酸式滴定管”或“碱式滴定管”),原因是 。
(2)碘量瓶在震荡静置时要塞紧塞子,可能的原因是
(3)滴定时向待测液中加入的指示剂是 ,到达滴定终点时的现象为 。
(4)用c 、V1和V2表示c(I3—)为 mol·L-1。
(5)若在测定1号瓶时,取上层清液时不小心吸入了少量的I2固体,则测定的c(I3—) (填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某氯化铁样品含有少FeC12杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行: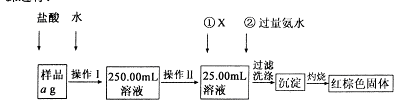
请根据上图流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 (填仪器名称),操作Ⅱ必须用到的仪器是 (填编号)。
| A.50mL烧杯 | B.50mL量筒 | C.100mL量筒 | D.25mL酸式滴定管 |
 。
。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com