
某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:
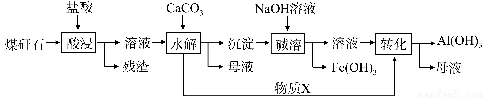
(1)“酸浸”过程中主要反应的离子方程式为__________?? 、____________。
(2)“酸浸”时铝浸出率的影响因素可能有_____? ________、_____? ______。(写出两个)
(3)物质X的化学式为___________。“碱溶”时反应的主要离子方程式为:Fe3++3OH- = Fe(OH)3↓;??????????????????? ????????????????? 。
(4)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是?????????????????????? 。
(5)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3溶液中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因:???????????????????????????????????????? 。
(1)Al2O3+6H+=2Al3++3H2O? ;? Fe2O3+6H+=2 Fe 3++3 H 2O???
(2)盐酸的浓度、反应温度、煤矸石颗粒大小、是否充分搅拌、反应时间(任写两个)
(3)CO2 ; Al(OH)3 +OH—=AlO2—+2H2O????
(4)加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后,再加CaCO3调节pH到5.4,过滤得到Al(OH)3
(5)AlCl3饱和溶液中存在溶解平衡:AlCl3·6H2O(s) Al3+(aq)+3Cl—(aq)+6H2O(l),通入HCl气体使溶液中c(Cl—)增大,平衡向析出固体的方向移动从而析出AlCl3晶体。
Al3+(aq)+3Cl—(aq)+6H2O(l),通入HCl气体使溶液中c(Cl—)增大,平衡向析出固体的方向移动从而析出AlCl3晶体。
【解析】
试题分析:(1)金属氧化物Al2O3、Fe2O3 能与酸反应,而非金属氧化物不能与酸反应。所以“酸浸”过程中主要反应的离子方程式为Al2O3+6H+=2Al3++3H2O? ;? Fe2O3+6H+=2Fe 3 ++3H2 O 。(2)在用酸溶解金属氧化物时,影响化学反应速率的元素有盐酸的浓度、反应温度、煤矸石颗粒大小、是否充分搅拌、反应时间等等。(3)在用酸溶解金属氧化物时酸可能过量,AlCl3、FeCl3都是强酸弱碱盐,水解使溶液显酸性。所以向该酸性溶液中加入CaCO3时发生反应:CaCO3+2H+=Ca2++ CO2↑+H2O。物质X是CO2。得到的沉淀是Al(OH)3、Fe(OH)3。加入NaOH溶液时,由于Al(OH)3是两性氢氧化物,能跟强碱反应溶解,发生反应为:Al(OH)3 +OH—=AlO2—+2H2O。(4)由于Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,而Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。所以为了得到纯净的Al(OH)3,首先加入CaCO3调节pH到3.2,得到Fe(OH)3,将其过滤除去后,再加CaCO3调节pH到5.4,这时又产生Al(OH)3。把它过滤出来并加以洗涤,即得到纯净的Al(OH)3。(5)常温下向AlCl3溶液中不断通入HCl气体,由于在AlCl3饱和溶液中存在溶解平衡:AlCl3·6H2O(s) Al3+(aq)+3Cl—(aq)+6H2O(l),通入HCl,即增大了生成物的浓度,化学平衡逆向移动。因此可析出大量AlCl3·6H2O晶体。
Al3+(aq)+3Cl—(aq)+6H2O(l),通入HCl,即增大了生成物的浓度,化学平衡逆向移动。因此可析出大量AlCl3·6H2O晶体。
考点:考查煤矸石的综合利用。主要包括金属氧化物的性质、Al(OH)3的两性、盐的水解平衡、离子方程式的书写、外界条件对化学反应速率、化学平衡移动的影响的知识。


科目:高中化学 来源:2013-2014学年广东省广州市毕业班综合测试一(一模)理综化学试卷(解析版) 题型:填空题
某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:
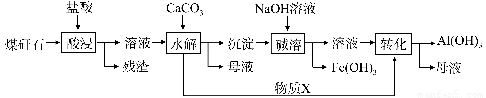
(1)“酸浸”过程中主要反应的离子方程式为_____________、_________________。
(2)“酸浸”时铝浸出率的影响因素可能有_____________、___________。(写出两个)
(3)物质X的化学式为___________。“碱溶”时反应的离子方程式为____________。
(4)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。为了获得产品Al(OH) 3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是____________________。
(5)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3溶液中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因:_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com