
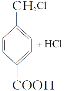
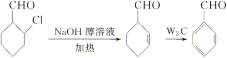
【题目】利用木质纤维可合成药物中间体H,还能合成高分子化合物G,合成路线如下:
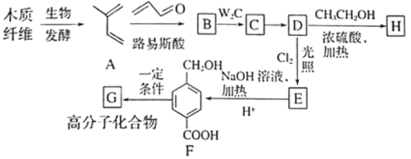
已知:①
②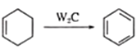
(1)A的化学名称是___________。
(2)B的结构简式是___________,由C生成D的反应类型为___________。
(3)化合物E的官能团为___________。
(4)F分子中处于同一平面的原子最多有___________个。D生成E的化学反应方程式为___________。
(5)芳香化合物I为H的同分异构体,苯环上一氯代物有两种结构,1molI发生水解反应消耗2 mol NaOH,符合要求的同分异构体有___________种,其中核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6︰3︰2︰1的I的结构简式为___________。
(6)写出用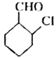 为原料制备
为原料制备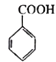 的合成路线(其他试剂任选)___________。
的合成路线(其他试剂任选)___________。
【答案】2-甲基-1,3-丁二烯 ![]() 氧化反应 氯原子、羧基 17
氧化反应 氯原子、羧基 17 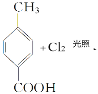
 10
10 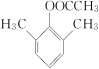 、
、

【解析】
结合框图和各步反应条件分析各物质结构简式为:由 可知,
可知,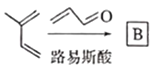 生成的B的结构简式为
生成的B的结构简式为![]() ,再根据
,再根据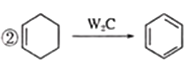 可知C为
可知C为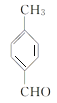 、D为
、D为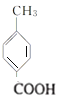 、H为
、H为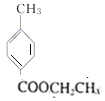 、E为
、E为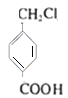 、F为
、F为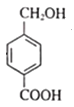 。结合各物质的性质进行解答。
。结合各物质的性质进行解答。
(1)由![]() 结构简式可知A的化学名称是2-甲基-1,3-丁二烯;答案:2-甲基-1,3-丁二烯;
结构简式可知A的化学名称是2-甲基-1,3-丁二烯;答案:2-甲基-1,3-丁二烯;
(2)结合上述分析可知B的结构简式是![]() ,由C为
,由C为 ,D为
,D为 可知,C生成D的反应类型为氧化反应。答案:
可知,C生成D的反应类型为氧化反应。答案:![]() ;氧化反应;
;氧化反应;
(3)结合上述分析可知E为 ,化合物E的官能团为氯原子、羧基;答案:氯原子、羧基。
,化合物E的官能团为氯原子、羧基;答案:氯原子、羧基。
(4)结合上述分析可知F为 ,苯环上12个原子共面,碳氧双键可以共面,单键可以旋转,所以羟基也可以共面,所以F分子中处于同一平面的原子最多有17个。由D为
,苯环上12个原子共面,碳氧双键可以共面,单键可以旋转,所以羟基也可以共面,所以F分子中处于同一平面的原子最多有17个。由D为 ,E为
,E为 可知,D生成E的化学反应方程式为
可知,D生成E的化学反应方程式为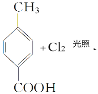
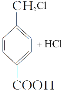 ;答案:.
;答案:.  。
。
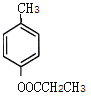
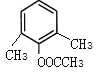
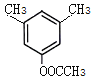
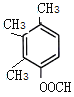
(5) H为 ,芳香化合物I为H的同分异构体,其苯环上一氯代物有两种结构,1molI发生水解反应消耗2 mol NaOH,则I为酚酯。符合要求的同分异构体有
,芳香化合物I为H的同分异构体,其苯环上一氯代物有两种结构,1molI发生水解反应消耗2 mol NaOH,则I为酚酯。符合要求的同分异构体有 、
、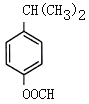 、
、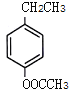 、
、 、
、 、
、 、
、 、
、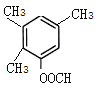 、
、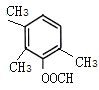 、
、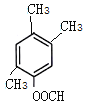 ,共10种,其中核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6︰3︰2︰1的I的结构简式为
,共10种,其中核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6︰3︰2︰1的I的结构简式为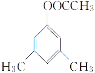 ,
,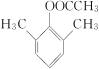 。答案:10,
。答案:10, ,
, .
.
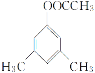
(6)结合 ,用
,用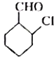 为原料制备
为原料制备 ,先发生消去反应在环上形成双键,然后发生脱氢反应生成苯环,最后发生氧化反应即可。具体的合成路线如下:
,先发生消去反应在环上形成双键,然后发生脱氢反应生成苯环,最后发生氧化反应即可。具体的合成路线如下: 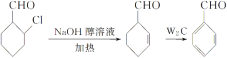
 ;答案:
;答案: 
 。
。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】在绿色植物体内存在一种RUBP羧化酶。该酶在CO2浓度较高时,催化C5与CO2反应,生成C3化合物;在O2浓度较高时,催化C5与O2反应,部分产物经一系列变化后转移到线粒体中会产生CO2,我们把这一过程又称为光呼吸(如图所示)。

光呼吸会消耗光合作用过程中新形成的有机物,还能消耗细胞内过多的ATP和还原剂[H],以防止它们的积累影响细胞的正常代谢。为了与光呼吸相区别,研究人员把细胞通常进行的呼吸成为“暗呼吸”。请回答:
(1)RUBP羧化酶的存在场所为_____________________,它的催化作用机理是____________________。
(2)在较高CO2浓度环境中,RUBP羧化酶所催化反应的产物是C3,该产物的还原还需要光反应提供_______________。
(3)光呼吸会降低农作物产量,但是在长期进化过程中却被保留下来,那么光呼吸存在的意义可能是________________、_____________________等。
(4)夏季中午,水稻出现“光合午休”现象,有机物的积累速率明显下降,其原因可能是因为叶片气孔的大量关闭使CO2浓度下降进而导致______________________________________________________。(从两个方面回答)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:__Fe2+___ClO-+( )___=____Fe(OH)3↓+__C1﹣+( )。
②检验滤液B中是否还含有铁元素的方法为:________(注明试剂、现象)。
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为___(填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、____(填操作名称)、洗涤。
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为___(填代号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二元弱酸 H2Y 溶液中滴加 KOH 溶液,所得混合溶液的 pH 与离子浓度变化的关系如下图所示,下列有关说法错误的是
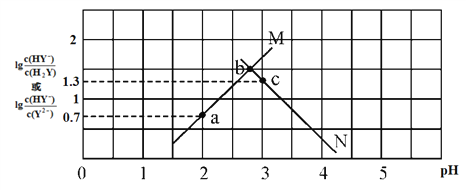
A. 曲线 M 表示 pH与 lg![]() 的变化关系
的变化关系
B. a点溶液中:c(H+) ― c(OH-)=2c(Y2-)+c(HY-) ― c(K+)
C. H2Y 的第二级电离常数Ka2(H2Y)=10-4.3
D. 交点b的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,请回答下列问题:
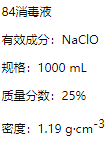
(1)该“84消毒液”的物质的量浓度约为________molL-1。(保留2位有效数字)
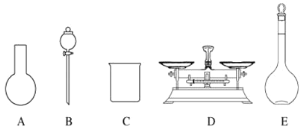
(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是________(填字母).
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0g
(3)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84gcm-3)的浓硫酸配制200mL 2.3 molL-1的稀硫酸用于增强“84消毒液”的消毒能力。
①需要量取浓硫酸的体积为________mL;(保留2位有效数字)
②定容时向容量瓶中注入蒸馏水,液面离刻度线下________时,改用胶头滴管滴加蒸馏水至________相切;
③在转移液体前需要注意的是(容量瓶已查漏且洗涤干净)________________________;
④下列操作会使配制的稀硫酸物质的量浓度偏大的是________;
A.容量瓶用蒸馏水洗涤后残留有少量的水
B.量取浓溶液读数时仰视刻度线
C.移液时玻璃棒在刻度线以上
D.定容观察液体时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B的结构简式如下:

(1)A分子中含有的官能团的名称是____________________________________。
(2)A、B能否与NaOH溶液反应:A________(填“能”或“不能”,下同),B________。
(3)A在浓硫酸作用下加热可得到B,其反应类型是____________________。
(4)A、B各1 mol分别加入足量溴水,完全反应后消耗单质溴的物质的量分别是________mol、________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ/mol,下列说法正确的是( )
A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D.该反应中的能量变化可用如图来表示
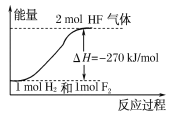
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在300 K时,A(g)+B(g) ![]() 2C(g)+D(s)的化学平衡常数K=4,在该温度下,向1 L容器中加入1 mol A和1 mol B发生反应,下列叙述不能作为该反应达到平衡状态的标志的是
2C(g)+D(s)的化学平衡常数K=4,在该温度下,向1 L容器中加入1 mol A和1 mol B发生反应,下列叙述不能作为该反应达到平衡状态的标志的是
①C的生成速率与C的消耗速率相等 ②单位时间内生成a mol A,同时消耗2a mol C ③A、B、C的浓度不再变化 ④C的物质的量不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的密度不再变化 ⑦A、B、C的分子数之比为1∶1∶2
A. ②⑤ B. ④⑦ C. ②③ D. ④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com