
����Ŀ����Ԫ������Ȼ������Ҫ��������������Ҫ�ɷ�ΪAl2O3��������Fe2O3��FeO��SiO2���С���ҵ�����������Ʊ�����ij�ֻ�����Ĺ����������¡�

��1������ҺA�м���Ư��Һ��Ŀ��������������������ҺB�����ԡ�
�ٸù������漰ij������ԭ��Ӧ���£�����ɣ�__Fe2+___ClO��+�� ��___=____Fe��OH��3��+__C1��+�� ����
�ڼ�����ҺB���Ƿ�����Ԫ�صķ���Ϊ��________��ע���Լ�������
�۽���ҺB�е���Ԫ���Գ�����ʽ��������ѡ�õ�����Լ�Ϊ___������ţ���
a������������Һ b��������Һ c����ˮ d��������̼
������ҺB�Ʊ��Ȼ��������漰�IJ���Ϊ���ߵμ�Ũ���������Ũ������ȴ�ᾧ��____����������ƣ���ϴ�ӡ�
��2��SiO2��NaOH�����Ʊ������ƣ��ɲ��õ�װ��Ϊ___������ţ���

���𰸡�2��1��5��H2O��1��4��H+ ȡ������ҺB������KSCN��Һ��������죬�ټ�����ˮ����Ȼ����죬˵����ҺB�в�����Ԫ�� c ���� b
��������
��1���������̷�������Һ�к����Ȼ������Ȼ��������Ȼ���������ҺA�м���Ư��Һ��Ŀ��������������������ҺB�����ԣ�����������Ӿ���������������������Ϊ����������Һ���γ���������������ȥ������������ԭ��Ӧ�����غ��ԭ���غ���ƽ�����ݳ������ӵļ��鷽���������
��2������ʵ��Ŀ�ļ��������ʷ���ѡ��ʵ��������
��1������Һ�к����Ȼ������Ȼ��������Ȼ���������ҺA�м���Ư��Һ��Ŀ��������������������ҺB�����ԣ�����������Ӿ���������������������Ϊ����������Һ���γ���������������ȥ���������ӱ�����Ϊ����������Һ���γ�������������������������ӱ���ԭΪ�����ӣ���Ӧ�����ӷ���ʽΪ��2Fe2++ClO-+5H2O=2Fe��OH��3��+C1-+4H+���ʴ�Ϊ��2��1��5��H2O��1��4��H+��
����ҺB���Ƿ�����Ԫ�صķ���Ϊ���������ӵļ��鷽�����м��飬ȡ������ҺB������KSCN��Һ��������죬�ټ�����ˮ����Ȼ����죬˵����ҺB�в�����Ԫ�أ��ʴ�Ϊ��ȡ������ҺB������KSCN��Һ��������죬�ټ�����ˮ����Ȼ����죬˵����ҺB�в�����Ԫ�أ�
����Һ�к��е����Ȼ�����Һ������ҺB�е���Ԫ���Գ�����ʽ������
a������������Һ���Գ��������ӵ��������ܽ�������������a������ã�
b��������Һ���ܳ��������ӣ���b�����ϣ�
c����ˮ��������ܽ����������������İ�ˮ���������γ����������������˵õ������������壬��c���ϣ�
d��������̼���Ȼ�������Ӧ������������������������d�����ϣ��ʴ�Ϊ��c��
�ܼ���Ũ���������Ȼ�����ˮ�⣬����Ũ����ȴ�ᾧ�����ˣ�ϴ�ӣ��ʴ�Ϊ�����ˣ�
��2��a�������������ڹ��壬��a�����ϣ�
b���������������ڶ���������������ƣ���b���ϣ�
c�������к�����������������Ʒ�Ӧ����c�����ϣ�
d�����������ж���������������Ʒ�Ӧ����d�����ϣ��ʴ�Ϊ��b��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ģ�±�������Ʊ��ж��ַ���������±�������ʺ�����Ӧ������±����Ӧ�Ƶõ���
A. ![]()
B. ![]()
C. ![]()
D. ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ڲ������з��뻹ԭ���ۺ�ʯ���ޣ��ɷ��������β��ϣ������۵����壩�Ļ����þƾ���Ƽ��Ȳ�ͨ��ˮ���������Թ��ռ������ľ���������塣

��1��д���йط�Ӧ�Ļ�ѧ����ʽ��________________��
��2��������ڿ�װ����Լ���________����������________��ʯ����������__________��
��3��ʵ�鿪ʼʱӦ�ȵ�ȼ________��ʵ�����ʱ��Ӧ��Ϩ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��XΪ��ѧ��ѧ�������ʣ�A��B��C������ͬԪ�ؼף����Է�������ת����ˮ����ķ�Ӧ��ˮδ�������
![]()
����˵������ȷ����
A.��A��B��C����ɫ��Ӧ�ʻ�ɫ��ˮ��Һ���ʼ��ԣ���X������CO2
B.��CΪ����ɫ���壬��Aһ��Ϊ�����к�����ߵ�����
C.��BΪFeCl3����Xһ����Fe
D.A������̼���ʣ�Ҳ������O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�����NOx��SO2����������Ҫ�ɷ֡�
I��NOx��Ҫ��Դ������β�����������û�ѧ����������ת��Ϊ���������ʡ�
��֪��N2(g)+O2(g)![]() 2NO(g) ��H=+180 kJ�� mol��1
2NO(g) ��H=+180 kJ�� mol��1
2CO(g)+O2(g)![]() 2CO2(g) ��H=��564 kJ�� mol��1
2CO2(g) ��H=��564 kJ�� mol��1
(1)2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) ��H=___________���÷�Ӧ��___________�����Է�����(����¡����¡��������¶ȡ�)
2CO2(g)+N2(g) ��H=___________���÷�Ӧ��___________�����Է�����(����¡����¡��������¶ȡ�)
(2)T��ʱ���������ʵ�����NO��CO�����ݻ�Ϊ2L���ܱ������У������¶Ⱥ�������䣬��Ӧ����0��5min��NO�����ʵ�����ʱ��仯����ͼ��ʾ��

����֪��ƽ��ʱ����ķ�ѹ=����������������ϵ����ѹǿ��T��ʱ�ﵽƽ�⣬��ʱ��ϵ����ѹǿΪ��=14MPa����T��ʱ�÷�Ӧ��ѹ��ƽ�ⳣ��Kp=___________MPa��1��ƽ������������г���NO��CO2��0.1mol��ƽ�⽫___________(��������ҡ���")�ƶ�
��15minʱ�����ı���練Ӧ����������n(NO)������ͼ��ʾ�ı仯����ı������������___________(����ĸ)
A������ B������COŨ�� C��������� D��С�������
��SO2��Ҫ��Դ��ú��ȼ�ա�ȼ����������������Ǽ��ٴ����к�������Ⱦ�Ĺؼ���
(1)��֪��������ĵ��볣��ΪKa1=2.0��10��2��Ka2=6.0��10��7����NaSO3��Һ��___________(����ԡ��������ԡ����ԡ�)
(2)��ͼ��ʾ�ĵ��װ�ã��ɽ������е�NO��SO2ת��Ϊ����泥��Ӷ�ʵ�ַ����Ļ��������á�ͨ��NO�ĵ缫��ӦʽΪ___________����ͨ���N���Ϊ4.48L(�����)��������һ���缫ͨ��SO2������������ӦΪ__________g��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ľ����ά�ɺϳ�ҩ���м���H�����ܺϳɸ߷��ӻ�����G���ϳ�·�����£�
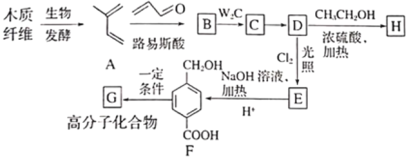
��֪����
��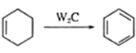
(1)A�Ļ�ѧ������___________��
(2)B�Ľṹ��ʽ��___________����C����D�ķ�Ӧ����Ϊ___________��
(3)������E�Ĺ�����Ϊ___________��
(4)F�����д���ͬһƽ���ԭ�������___________����D����E�Ļ�ѧ��Ӧ����ʽΪ___________��
(5)���㻯����IΪH��ͬ���칹��,������һ�ȴ��������ֽṹ,1molI����ˮ�ⷴӦ����2 mol NaOH,����Ҫ���ͬ���칹����___________��,���к˴Ź���������ʾ��4�ֲ�ͬ��ѧ��������,�������Ϊ6�U3�U2�U1��I�Ľṹ��ʽΪ___________��
(6)д����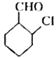 Ϊԭ���Ʊ�
Ϊԭ���Ʊ�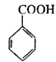 �ĺϳ�·��(�����Լ���ѡ)___________��
�ĺϳ�·��(�����Լ���ѡ)___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С����ʵ����ģ�ҵ�ϴ�Ũ����ˮ����ȡ��Ĺ������̣��������װ�ý���ʵ��(��������Ʒ���ѱ��������г�װ������ȥ)������˵���������

A.װ����ͨ�����a������Cl2
B.ʵ��ʱӦ��Aװ����ͨ��a����һ��ʱ���ֹͣͨ�룬��ͨ���ȿ���
C.Bװ����ͨ��a����ǰ�����ķ�ӦΪSO2+ Br2+2H2O===H2SO4+2HBr
D.Cװ�õ�����ֻ�����ն���Ķ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ľ����ά�ɺϳ�ҩ���м���H�����ܺϳɸ߷��ӻ�����G���ϳ�·�����£�
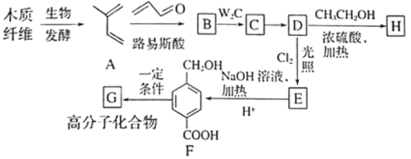
��֪����
��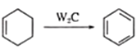
(1)A�Ļ�ѧ������___________��
(2)B�Ľṹ��ʽ��___________����C����D�ķ�Ӧ����Ϊ___________��
(3)������E�Ĺ�����Ϊ___________��
(4)F�����д���ͬһƽ���ԭ�������___________����D����E�Ļ�ѧ��Ӧ����ʽΪ___________��
(5)���㻯����IΪH��ͬ���칹��,������һ�ȴ��������ֽṹ,1molI����ˮ�ⷴӦ����2 mol NaOH,����Ҫ���ͬ���칹����___________��,���к˴Ź���������ʾ��4�ֲ�ͬ��ѧ��������,�������Ϊ6�U3�U2�U1��I�Ľṹ��ʽΪ___________��
(6)д����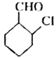 Ϊԭ���Ʊ�
Ϊԭ���Ʊ�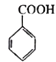 �ĺϳ�·��(�����Լ���ѡ)___________��
�ĺϳ�·��(�����Լ���ѡ)___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̽����Ƭ��Na2CO3��Һ�ķ�Ӧ��
|
| |
���������� | ��Ƭ�������ϸС���� | ���ְ�ɫ���ǣ������������ݣ�������ΪH2��CO2�� |
����˵������ȷ����
A.�ԱȢ�˵��Na2CO3��Һ���ƻ�������ı���Ĥ
B.�Ʋ���ְ�ɫ���ǵ�ԭ��AlO2- + HCO3- + H2O = Al��OH��3��+ CO32-
C.���Ⱥ�H2�ݳ���CO32- ˮ��ƽ���ƶ������Ӱ�����෴��
D.Na2CO3��Һ�д���ˮ��ƽ�⣺CO32- + H2O HCO3- + OH-
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com