
ΓΨΧβΡΩΓΩ―–ΨΩΖΔœ÷NOxΚΆSO2 «Έμω≤ΒΡ÷ς“Σ≥…Ζ÷ΓΘ
IΘ°NOx÷ς“Σά¥‘¥”ΎΤϊ≥ΒΈ≤ΤχΘ§Ω…“‘άϊ”ΟΜ·―ßΖΫΖ®ΫΪΕΰ’ΏΉΣΜ·ΈΣΈόΕΨΈόΚΠΒΡΈο÷ ΓΘ
“―÷ΣΘΚN2(g)+O2(g)![]() 2NO(g) ΓςH=+180 kJΓΛ molΘ≠1
2NO(g) ΓςH=+180 kJΓΛ molΘ≠1
2CO(g)+O2(g)![]() 2CO2(g) ΓςH=Θ≠564 kJΓΛ molΘ≠1
2CO2(g) ΓςH=Θ≠564 kJΓΛ molΘ≠1
(1)2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) ΓςH=___________Θ§ΗΟΖ¥”Π‘Ύ___________œ¬ΡήΉ‘ΖΔΫχ––(ΧνΓΑΗΏΈ¬Γ±ΒΆΈ¬Γ±ΜρΓΑ»Έ“βΈ¬Ε»Γ±)
2CO2(g)+N2(g) ΓςH=___________Θ§ΗΟΖ¥”Π‘Ύ___________œ¬ΡήΉ‘ΖΔΫχ––(ΧνΓΑΗΏΈ¬Γ±ΒΆΈ¬Γ±ΜρΓΑ»Έ“βΈ¬Ε»Γ±)
(2)TΓφ ±Θ§ΫΪΒ»Έο÷ ΒΡΝΩΒΡNOΚΆCO≥δ»κ»ίΜΐΈΣ2LΒΡΟή±’»ίΤς÷–Θ§±Θ≥÷Έ¬Ε»ΚΆΧεΜΐ≤Μ±δΘ§Ζ¥”ΠΙΐ≥Χ0Θ≠5min÷–NOΒΡΈο÷ ΒΡΝΩΥφ ±Φδ±δΜ·»γ”“ΆΦΥυ ΨΓΘ

ΔΌ“―÷ΣΘΚΤΫΚβ ±ΤχΧεΒΡΖ÷―Ι=ΤχΧεΒΡΧεΜΐΖ÷ ΐΓΝΧεœΒΒΡΉή―Ι«ΩΘ§TΓφ ±¥οΒΫΤΫΚβΘ§¥Υ ±ΧεœΒΒΡΉή―Ι«ΩΈΣΘ–=14MPaΘ§‘ρTΓφ ±ΗΟΖ¥”ΠΒΡ―ΙΝΠΤΫΚβ≥Θ ΐKp=___________MPaΘ≠1ΘΜΤΫΚβΚσΘ§‘Όœρ»ίΤς÷–≥δ»κNOΚΆCO2Ης0.1molΘ§ΤΫΚβΫΪ___________(ΧνΓΑœρΉσΓ±ΓΑœρ”“Γ±ΜρΓΑ≤Μ")“ΤΕ·
ΔΎ15min ±Θ§»τΗΡ±δΆβΫγΖ¥”ΠΧθΦΰΘ§ΒΦ÷¬n(NO)ΖΔ…ζ»γΆΦΥυ ΨΒΡ±δΜ·Θ§‘ρΗΡ±δΒΡΧθΦΰΩ…Ρή «___________(ΧνΉ÷ΡΗ)
AΘ°…ΐΈ¬ BΘ°‘ω¥σCO≈®Ε» CΘ°Φ”»κ¥ΏΜ·ΦΝ DΦθ–Γ»ίΤςΧεΜΐ
ΔρΘ°SO2÷ς“Σά¥‘¥”ΎΟΚΒΡ»Φ…’ΓΘ»Φ…’―ΧΤχΒΡΆ―ΝρΦθ≈≈ «Φθ…Ό¥σΤχ÷–Κ§ΝρΜ·ΚœΈοΈέ»ΨΒΡΙΊΦϋΓΘ
(1)“―÷ΣΘΚ―«ΝρΥαΒΡΒγάκ≥Θ ΐΈΣKa1=2.0ΓΝ10Θ≠2Θ§Ka2=6.0ΓΝ10Θ≠7ΓΘ‘ρNaSO3»ή“Κ≥ ___________(ΧνΓΑΥα–‘Γ±ΓΔΓΑ÷––‘Γ±ΜρΓΑΦν–‘Γ±)
(2)»γΆΦΥυ ΨΒΡΒγΫβΉΑ÷ΟΘ§Ω…ΫΪΈμω≤÷–ΒΡNOΓΔSO2ΉΣΜ·ΈΣΝρΥαοßΘ§¥”Εχ Βœ÷ΖœΤχΒΡΜΊ ’‘Όάϊ”ΟΓΘΆ®»κNOΒΡΒγΦΪΖ¥”Π ΫΈΣ___________ΘΜ»τΆ®»κΒΡNΧεΜΐΈΣ4.48L(±ξΩωœ¬)Θ§‘ρΝμΆβ“ΜΗωΒγΦΪΆ®»κSO2ΒΡ÷ ΝΩάμ¬έ…œ”ΠΈΣ__________gΓΘ

ΓΨ¥πΑΗΓΩΘ≠744 kJΓΛmolΘ≠1 ΒΆΈ¬ 0.125(Μρ1/8) ≤Μ BD Υα–‘ 6HΘΪΘΪNOΘΪ5eΘ≠===NH4+ΘΪH2O 32
ΓΨΫβΈωΓΩ
ΗυΨίΗ«ΥΙΕ®¬…ΚΆΓςG=ΓςHTΓςS<0Ϋβ¥πΘΜΗυΨί»ΐΕΈ Ϋ, Μ·―ßΤΫΚβ≥Θ ΐK ”κQcΒΡΙΊœΒΫχ––≈–ΕœΘΜΗυΨί 15min ±,ΗΡ±δΡ≥“Μ“ρΥΊ,NOΒΡΈο÷ ΒΡΝΩΦθ…Ό,ΥΒΟςΤΫΚβœρ’ΐΖ¥”ΠΖΫœρ“ΤΕ·,ΫαΚœΜ·―ßΤΫΚβΒΡ”Αœλ“ρΥΊΖ÷ΈωΘΜΗυΨίHSO3ΒΡΒγάκΤΫΚβ≥Θ ΐ”κΥ°ΫβΤΫΚβ≥Θ ΐ¥σ–Γ≈–ΕœΘΜΗυΨίΒγΫβΉΑ÷ΟΒΟ ßΒγΉ” ΐΡΩ ΊΚψΫχ––ΦΤΥψΓΘ
Θ®1Θ©ΗυΨίΗ«ΥΙΕ®¬…ΔΌN2(g)+O2(g)![]() 2NO(g) ΓςH=+180 kJΓΛ molΘ≠1 ΔΎ2CO(g)+O2(g)
2NO(g) ΓςH=+180 kJΓΛ molΘ≠1 ΔΎ2CO(g)+O2(g)![]() 2CO2(g) ΓςH=Θ≠564 kJΓΛ molΘ≠1,ΔΎΔΌΒΟΘΚ2NO(g)+2CO(g)
2CO2(g) ΓςH=Θ≠564 kJΓΛ molΘ≠1,ΔΎΔΌΒΟΘΚ2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) ΓςH= (564180)kJmol1=744kJmol1Θ§ΗΟΖ¥”ΠΈΣΤχΧεΧεΜΐΥθ–ΓΒΡΖ≈»»Ζ¥”ΠΘ§ΤδΓςH<0ΓΔΓςS<0Θ§‘ρΈ¬Ε»¥Π”ΎΒΆΈ¬œ¬¬ζΉψΓςG=ΓςHTΓςS<0Θ§ΡήΉ‘ΖΔΫχ––ΘΜΙ ¥πΑΗΈΣΘΚ744kJmol1ΘΜΒΆΈ¬ΘΜ
2CO2(g)+N2(g) ΓςH= (564180)kJmol1=744kJmol1Θ§ΗΟΖ¥”ΠΈΣΤχΧεΧεΜΐΥθ–ΓΒΡΖ≈»»Ζ¥”ΠΘ§ΤδΓςH<0ΓΔΓςS<0Θ§‘ρΈ¬Ε»¥Π”ΎΒΆΈ¬œ¬¬ζΉψΓςG=ΓςHTΓςS<0Θ§ΡήΉ‘ΖΔΫχ––ΘΜΙ ¥πΑΗΈΣΘΚ744kJmol1ΘΜΒΆΈ¬ΘΜ
(2)ΔΌ”…ΆΦ1÷Σ,2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)Θ§
2CO2(g)+N2(g)Θ§
Τπ Φ(mol) 0.4 0.4 0 0
ΉΣΜ·(mol) 0.2 0.2 0.2 0.1
ΤΫΚβ(mol) 0.2 0.2 0.2 0.1
ΗςΉιΖ÷ΒΡΧεΜΐΖ÷ ΐΖ÷±π «ΘΚ![]() ΓΔ
ΓΔ![]() ΓΔ
ΓΔ![]() ΓΔ
ΓΔ![]() Θ§,Kp=
Θ§,Kp=![]() =(14ΓΝ
=(14ΓΝ![]() )2ΓΝ(14
)2ΓΝ(14![]() )/ [(14ΓΝ
)/ [(14ΓΝ![]() )2ΓΝ(14ΓΝ
)2ΓΝ(14ΓΝ![]() )2]=0.125ΘΜΗυΨίΔΌΒΡΖ÷Έω,Μ·―ßΤΫΚβ≥Θ ΐK=
)2]=0.125ΘΜΗυΨίΔΌΒΡΖ÷Έω,Μ·―ßΤΫΚβ≥Θ ΐK=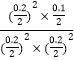 =5,‘Όœρ»ίΤς÷–≥δ»κNOΚΆCO2Ης0.3molΘ§¥Υ ±ΒΡ≈®Ε»…ΧQc=
=5,‘Όœρ»ίΤς÷–≥δ»κNOΚΆCO2Ης0.3molΘ§¥Υ ±ΒΡ≈®Ε»…ΧQc=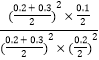 =5=KΘ§“ρ¥ΥΤΫΚβ≤Μ“ΤΕ·ΘΜΙ ¥πΑΗΈΣΘΚ0.125ΘΜ≤ΜΘΜ
=5=KΘ§“ρ¥ΥΤΫΚβ≤Μ“ΤΕ·ΘΜΙ ¥πΑΗΈΣΘΚ0.125ΘΜ≤ΜΘΜ
ΔΎ15min ±Θ§ΗΡ±δΡ≥“Μ“ρΥΊΘ§NOΒΡΈο÷ ΒΡΝΩΦθ…ΌΘ§ΥΒΟςΤΫΚβœρ’ΐΖ¥”ΠΖΫœρ“ΤΕ·ΘΚ
A. ’ΐΖ¥”Π «Ζ≈»»Ζ¥”ΠΘ§…ΐΈ¬Θ§ΤΫΚβœρΡφΖ¥”ΠΖΫœρ“ΤΕ·Θ§NOΒΡΈο÷ ΒΡΝΩ‘ω¥σΘ§Ι A¥μΈσΘΜ
B. ‘ω¥σCOΒΡ≈®Ε»Θ§ΤΫΚβœρ’ΐΖ¥”ΠΖΫœρ“ΤΕ·Θ§NOΒΡΈο÷ ΒΡΝΩΦθ–ΓΘ§Ι B’ΐ»ΖΘΜ
C. Φ”»κ¥ΏΜ·ΦΝΘ§Μ·―ßΤΫΚβ≤Μ“ΤΕ·Θ§Ι C¥μΈσΘΜ
D. Φθ–Γ»ίΤςΒΡΧεΜΐΘ§œύΒ±”Ύ‘ω¥σ―Ι«ΩΘ§ΤΫΚβœρ’ΐΖ¥”ΠΖΫœρ“ΤΕ·Θ§NOΈο÷ ΒΡΝΩΦθ–ΓΘ§Ι D’ΐ»ΖΘΜ
Ι ¥πΑΗΈΣΘΚBDΘΜ
Δρ(1)”…”ΎHSO3ΒΡΥ°Ϋβ≥Θ ΐK=Kw/Ka1=5.0ΓΝ1013<Ka2=6.0ΓΝ107,ΥΒΟςHSO3ΒΡΒγάκΤΫΚβ≥Θ ΐ¥σ”ΎΥ°ΫβΤΫΚβ≥Θ ΐΘ§‘ρHSO3ΒΡ»ή“Κœ‘Υα–‘ΘΜ¥πΑΗΘΚΥα–‘ΘΜ
(2)ΗυΨίΒγΫβΉΑ÷ΟΘ§NOΚΆSO2ΉΣΜ·ΈΣΝρΥαοßΘ§ΥΒΟςNOΉΣΜ·≥…NH4+Θ§Φ¥NO‘Ύ“θΦΪ…œΖΔ…ζΖ¥”ΠNO+6H++5e=NH4++H2OΘ§―τΦΪΖ¥”Π ΫΈΣSO2+2H2O2e=4H++SO42,ΗυΨίΒΟ ßΒγΉ” ΐΡΩ ΊΚψΘ§”–2NO10e5SO2Θ§‘ρSO2ΒΡΈο÷ ΒΡΝΩΈΣΘΚn(SO2)=5/2n(NO)=4.48L/22.4Lmol-1ΓΝ5/2=0.5molΘ§SO2ΒΡ÷ ΝΩΈΣ64g/molΓΝ0.5mol=32gΘ§Ι ¥πΑΗΈΣΘΚ6HΘΪΘΪNOΘΪ5eΘ≠===NH4+ΘΪH2OΘΜ32ΓΘ



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ…ηNA±μ ΨΑΔΖϋΦ”Β¬¬ό≥Θ ΐΒΡ÷ΒΘ§œ¬Ν–≈–Εœ’ΐ»ΖΒΡ «(ΓΓΓΓ)
A.‘Ύ≥ΘΈ¬≥Θ―Ιœ¬Θ§48 g―θΤχΚΆ≥τ―θΒΡΜλΚœΤχΧεΚ§―θ‘≠Ή” ΐ «3NA
B.±ξΉΦΉ¥Ωωœ¬Θ§22.4 L H2O÷–Κ§”–ΒΡ‘≠Ή” ΐΡΩΈΣ3NA
C.Ά§Έ¬Ά§―Ιœ¬Θ§NAΗωCO2”κNAΗωN2ΚΆO2ΒΡΜλΚœΤχΧεΒΡΧεΜΐ≤ΜœύΒ»
D.Έο÷ ΒΡΝΩ≈®Ε»ΈΣ0.5 molΓΛLΘ≠1ΒΡMgCl2»ή“Κ÷–Θ§Κ§”–ClΘ≠ ΐΈΣNA
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΈΣΧΫΨΩΥα”ξΕ‘÷≤Έο“ΕΤ§ΙβΚœΉς”ΟΒΡ”ΑœλΘ§ΩΤ―––ΓΉι Ι”ΟΡ≥÷÷÷≤Έο”ΉΟγΉςΈΣ Β―ι≤ΡΝœΘ§Ε‘ΤδΫχ––ΡΘΡβΥα”ξ¥ΠάμΘ§≤ΩΖ÷ΫαΙϊ»γ±μ1ΚΆΆΦ1ΘΚ
Ήι±π | ΡΘΡβΥα”ξ÷Β | “Ε¬ΧΥΊa(mg/g) | “Ε¬ΧΥΊ b(mg/g) |
A | pH7Θ°0 | 2Θ°29 | 0Θ°94 |
B | pH4Θ°5 | 2Θ°32 | 0Θ°95 |
C | pH3Θ°5 | 2Θ°14 | 0Θ°86Θ° |
D | pH2Θ°5 | 1Θ°41 | 0Θ°73 |
±μ1ΘΚΡΘΡβΥα”ξΕ‘Ρ≥÷÷÷≤Έο”ΉΟγ“ΕΤ§ΙβΚœ…ΪΥΊΚ§ΝΩΒΡ”Αœλ

Θ®1Θ©¬Χ“Ε÷–…ΪΥΊΒΡΧα»Γ≥Θ”Ο______Ήω»ήΦΝΘ§ΤδΖ÷άκ‘ράϊ”ΟΝΥ≤ΜΆ§…ΪΥΊ‘Ύ”–Μζ»ήΦΝ÷–______≤ΜΆ§ΒΡΧΊΒψΓΘ
Θ®2Θ©±Ψ Β―ι÷–AΉιΒΡΉς”Ο «________Θ§Τδ”ύΉι±Ί–κ”κAΉι±Θ≥÷œύΆ§ΒΡΜΖΨ≥“ρΥΊ”–________( ‘ΨΌΝΫœν)ΓΘ
Θ®3Θ©«κΫαΚœ±μ1Ζ÷ΈωΥα”ξ”Αœλ÷≤ΈοΙβΚœΥΌ¬ ΒΡ‘≠“ρΘΚ_________________________________ΓΘ
Θ®4Θ©ΗυΨί»ή“Κ÷–Ρ≥Έο÷ Ε‘“ΜΕ®≤®≥ΛΙβΒΡΈϋ ’÷Β”κΤδ≈®Ε»≥…’ΐ±»ΒΡ‘≠άμΘ§Ω…Ε‘Χα»ΓΒΡ…ΪΥΊΚ§ΝΩΫχ––≤βΕ®ΓΘœ÷“Σ≤βΕ®…ΪΥΊΧα»Γ“Κ÷–“Ε¬ΧΥΊaΒΡΚ§ΝΩΘ§Υυ―ΓΙβΒΡ≤®≥ΛΈΣ665nmΘ§Εχ≤Μ «“Ε¬ΧΥΊaΈϋ ’ΙβΡήΑΌΖ÷±»ΗϋΗΏΒΡ425nmΘ§«κΗυΨίΆΦ2Ζ÷Έω‘≠“ρΓΘ______________________________
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΥ°―νΥαΒΡΫαΙΙΦρ ΫΈΣ![]() Θ§Υ°―νΥαθΞEΈΣΉœΆβΈϋ ’ΦΝΘ§Ω…”Ο”Ύ≈δ÷ΤΖά…ΙΥΣΓΘEΒΡ“Μ÷÷Κœ≥…¬ΖœΏ»γœ¬ΘΚ
Θ§Υ°―νΥαθΞEΈΣΉœΆβΈϋ ’ΦΝΘ§Ω…”Ο”Ύ≈δ÷ΤΖά…ΙΥΣΓΘEΒΡ“Μ÷÷Κœ≥…¬ΖœΏ»γœ¬ΘΚ

“―÷ΣΘΚ2RCH2CHO ΓΘΜΊ¥πœ¬Ν–Έ ΧβΘΚ
ΓΘΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©±ΞΚΆ“Μ‘Σ¥ΦA÷–―θΒΡ÷ ΝΩΖ÷ ΐ‘ΦΈΣ21.6%Θ§‘ρAΒΡΖ÷Ή” ΫΈΣ________ΘΜΫαΙΙΖ÷Έωœ‘ ΨA÷Μ”–“ΜΗωΦΉΜυΘ§AΒΡΟϊ≥ΤΈΣ_____ΓΘ
Θ®2Θ©ΒΎΔέ≤ΫΒΡΖ¥”Πάύ–ΆΈΣ____ΘΜ D÷–ΥυΚ§ΙΌΡήΆ≈ΒΡΟϊ≥ΤΈΣ______ΘΜ
Θ®3Θ©ΒΎΔΌ≤ΫΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ______ΓΘ
Θ®4Θ©EΒΡΖ÷Ή” Ϋ «______ΓΘ
Θ®5Θ©1molΥ°―νΥαΖ÷±πœϊΚΡNaOHΓΔNaHCO3ΒΡΈο÷ ΒΡΝΩ÷°±» «______ΓΘ
Θ®6Θ©X «±»Υ°―νΥαΕύ“ΜΗωΧΦ‘≠Ή”ΒΡΆ§œΒΈοΓΘXΒΡΆ§Ζ÷“λΙΙΧε÷–Θ§ΖϊΚœœ¬Ν–ΧθΦΰΒΡΙ≤__÷÷Θ§Τδ÷–»Γ¥ζΜυ‘Ύ±ΫΜΖΒΡΕ‘ΈΜ«“ΡήœϊΚΡ3molNaOHΒΡΆ§Ζ÷“λΙΙΧεΒΡΫαΙΙΦρ Ϋ «_______ΓΘΔΌ±ΫΜΖ…œ”–ΝΫΗω»Γ¥ζΜυΔΎ”κFeCl3ΖΔ…ζœ‘…ΪΖ¥”ΠΔέΡήΖΔ…ζΥ°ΫβΖ¥”Π
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΦλ―ιΡ≥»ή“Κ÷– «ΖώΚ§”–![]() Θ§≥Θ”ΟΒΡΖΫΖ® «( )
Θ§≥Θ”ΟΒΡΖΫΖ® «( )
A.»Γ―υΘ§ΒΈΦ”BaCl2»ή“ΚΘ§Ω¥ «Ζώ”–≤Μ»ή”ΎΥ°ΒΡΑΉ…Ϊ≥ΝΒμ…ζ≥…
B.»Γ―υΘ§ΒΈΦ”œΓ―ΈΥαΥαΜ·ΒΡBaCl2»ή“ΚΘ§Ω¥ «Ζώ”–≤Μ¬δ”ΎΥ°ΒΡΑΉ…Ϊ≥ΝΒμ…ζ≥…
C.»Γ―υΘ§ΒΈΦ”œΓΝρΥαΘ§‘ΌΒΈΦ”BaCl2»ή“ΚΘ§Ω¥ «Ζώ”–≤Μ¬δ”ΎΥ°ΒΡΑΉ…Ϊ≥ΝΒμ…ζ≥…
D.»Γ―υΘ§ΒΈΦ”œΓ―ΈΥαΘ§ΈόΟςœ‘œ÷œσΘ§‘ΌΒΈΦ”BaCl2¬δ“ΚΘ§Ω¥ «Ζώ”–≤Μ»ή”ΎΥ°ΒΡΑΉ…Ϊ≥ΝΒμ…ζ≥…
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ¬Ν‘ΣΥΊ‘ΎΉ‘»ΜΫγ÷–÷ς“Σ¥φ‘Ύ”Ύ¬ΝΆΝΩσΘ®÷ς“Σ≥…Ζ÷ΈΣAl2O3Θ§ΜΙΚ§”–Fe2O3ΓΔFeOΓΔSiO2Θ©÷–ΓΘΙΛ“Β…œ”Ο¬ΝΆΝΩσ÷Τ±Η¬ΝΒΡΡ≥÷÷Μ·ΚœΈοΒΡΙΛ“’Νς≥Χ»γœ¬ΓΘ

Θ®1Θ©‘Ύ¬Υ“ΚA÷–Φ”»κΤ·ΑΉ“ΚΘ§ΡΩΒΡ «―θΜ·≥ΐΧζΘ§ΥυΒΟ¬Υ“ΚBœ‘Υα–‘ΓΘ
ΔΌΗΟΙΐ≥Χ÷–…φΦΑΡ≥―θΜ·ΜΙ‘≠Ζ¥”Π»γœ¬Θ§«κΆξ≥…ΘΚ__Fe2+___ClOΘ≠+Θ® Θ©___=____FeΘ®OHΘ©3Γΐ+__C1©¹+Θ® Θ©ΓΘ
ΔΎΦλ―ι¬Υ“ΚB÷– «ΖώΜΙΚ§”–Χζ‘ΣΥΊΒΡΖΫΖ®ΈΣΘΚ________Θ®ΉΔΟς ‘ΦΝΓΔœ÷œσΘ©ΓΘ
ΔέΫΪ¬Υ“ΚB÷–ΒΡ¬Ν‘ΣΥΊ“‘≥ΝΒμ–Έ ΫΈω≥ωΘ§Ω…―Γ”ΟΒΡΉνΚΟ ‘ΦΝΈΣ___Θ®Χν¥ζΚ≈Θ©ΓΘ
aΘ°«β―θΜ·ΡΤ»ή“Κ bΘ°ΝρΥα»ή“Κ cΘ°Α±Υ° dΘ°Εΰ―θΜ·ΧΦ
Δή”…¬Υ“ΚB÷Τ±Η¬»Μ·¬ΝΨßΧε…φΦΑΒΡ≤ΌΉςΈΣΘΚ±ΏΒΈΦ”≈®―ΈΥα±Ώ’τΖΔ≈®ΥθΓΔά以ΫαΨßΓΔ____Θ®Χν≤ΌΉςΟϊ≥ΤΘ©ΓΔœ¥Β”ΓΘ
Θ®2Θ©SiO2ΚΆNaOH±Κ…’÷Τ±ΗΙηΥαΡΤΘ§Ω…≤…”ΟΒΡΉΑ÷ΟΈΣ___Θ®Χν¥ζΚ≈Θ©ΓΘ

≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΈ“ΙζΡ≥ΒΊΖέΟΚΜ“÷–οΊΚ§ΝΩΖαΗΜΘ§Τδ÷ς“Σ≥…Ζ÷“‘Ga2O3ΒΡ–Έ Ϋ¥φ‘ΎΘ§≥ΐ¥Υ÷°ΆβΜΙΚ§”–A12O3ΓΔFe3O4ΓΔSiO2Β»‘”÷ ΓΘ“―÷Σ¥”ΖέΟΚΜ“÷–ΜΊ ’οΊΒΡ“’Νς≥Χ»γΆΦΦΉΥυ ΨΓΘ

–≈œΔΘΚ(i)ΉΣ–Ά“Κ÷–οΊ“‘GaO2Θ≠ΒΡ–Έ Ϋ¥φ‘ΎΘΜ
(ii)Ksp[Ga(OH3)]=1.4ΓΝ10Θ≠34Θ§Ksp[Fe(OH)3]=2.7ΓΝ10Θ≠39Θ§Ksp[Fe(OH)2]=4.87ΓΝ10Θ≠17ΓΘ
ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
(1)¬Υ‘ϋA÷–“ΜΕ®Κ§”–ΒΡ≥…Ζ÷ «___________ΓΘ
(2)ΓΑ―θΜ·Γ±Ιΐ≥Χ÷–Φ”»κH2O2ΒΡΡΩΒΡ «___________Θ§ΗΟΙΐ≥Χ÷–ΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ___________ΓΘ
(3)œ¥Ά―“Κ÷–ΜΙ”–…ΌΝΩΒΡFe3+ΓΔGa3+Θ§Τδ÷–Ga3+≈®Ε»ΈΣ1.4ΓΝ10Θ≠4mol/LΘ§Ν– ΫΦΤΥψΒ±Fe3+«ΓΚΟ≥ΝΒμΆξ»Ϊ ±[c(Fe3+)Γή1.0ΓΝ10Θ≠5mol/L]Θ§G a3+ «ΖώΩΣ Φ≥ΝΒμ___________ΓΘ
(4)Νς≥ΧΆΦ÷–ΝΫ¥ΈΒςΫΎpHΒΡΡΩΒΡΖ÷±π «___________ΓΘ
(5)ΒγΫβΖ®Ω…“‘Χα¥Ω¥÷οΊΘ§ΨΏΧε‘≠άμ»γΆΦ““Υυ ΨΔΌ¥÷οΊ”κΒγ‘¥___________ΦΪœύΝ§(ΧνΓΑ’ΐΓ±ΜρΓΑΗΚΓ±)ΓΘΔΎοΊ‘Ύ―τΦΪ»ήΫβ…ζ≥…ΒΡGa3+”κNaOH»ή“ΚΖ¥”Π…ζ≥…GaO2Θ≠Θ§GaO2Θ≠‘Ύ“θΦΪΖ≈ΒγΒΡΒγΦΪΖ¥”Π ΫΈΣ___________ΓΘ

≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷ΣΡ≥ΓΑ84œϊΕΨ“ΚΓ±ΤΩΧε≤ΩΖ÷±ξ«©»γΆΦΥυ ΨΘ§«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
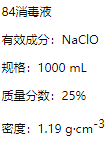
(1)ΗΟΓΑ84œϊΕΨ“ΚΓ±ΒΡΈο÷ ΒΡΝΩ≈®Ε»‘ΦΈΣ________molL-1ΓΘ(±ΘΝτ2ΈΜ”––ß ΐΉ÷)
(2)ΗΟΆ§―ß≤Έ‘ΡΗΟΓΑ84œϊΕΨ“ΚΓ±ΒΡ≈δΖΫΘ§”ϊ”ΟNaClOΙΧΧε≈δ÷Τ480 mLΚ§NaClO÷ ΝΩΖ÷ ΐΈΣ25%ΒΡœϊΕΨ“ΚΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «________(ΧνΉ÷ΡΗ).
AΘ°»γΆΦΥυ ΨΒΡ“«Τς÷–Θ§”–»ΐ÷÷ «≤Μ–η“ΣΒΡΘ§ΜΙ–η“Σ“Μ÷÷≤ΘΝß“«Τς
BΘ°»ίΝΩΤΩ”Ο’τΝσΥ°œ¥ΨΜΚσΘ§”ΠΚφΗ…Κσ≤≈Ρή”Ο”Ύ»ή“Κ≈δ÷Τ
CΘ°≈δ÷ΤΙΐ≥Χ÷–Θ§Έ¥”Ο’τΝσΥ°œ¥Β”…’±≠ΚΆ≤ΘΝßΑτΩ…ΡήΒΦ÷¬ΫαΙϊΤΪΒΆ
DΘ°–η“Σ≥ΤΝΩNaClOΙΧΧεΒΡ÷ ΝΩΈΣ143.0g
(3)ΓΑ84œϊΕΨ“ΚΓ±”κœΓΝρΥαΜλΚœ Ι”ΟΩ…‘ω«ΩœϊΕΨΡήΝΠΘ§Ρ≥œϊΕΨ–ΓΉι»Υ‘±”Ο98%(ΟήΕ»ΈΣ1.84gcm-3)ΒΡ≈®ΝρΥα≈δ÷Τ200mL 2.3 molL-1ΒΡœΓΝρΥα”Ο”Ύ‘ω«ΩΓΑ84œϊΕΨ“ΚΓ±ΒΡœϊΕΨΡήΝΠΓΘ
ΔΌ–η“ΣΝΩ»Γ≈®ΝρΥαΒΡΧεΜΐΈΣ________mLΘΜ(±ΘΝτ2ΈΜ”––ß ΐΉ÷)
ΔΎΕ®»ί ±œρ»ίΝΩΤΩ÷–ΉΔ»κ’τΝσΥ°Θ§“ΚΟφάκΩΧΕ»œΏœ¬________ ±Θ§ΗΡ”ΟΫΚΆΖΒΈΙήΒΈΦ”’τΝσΥ°÷Ν________œύ«–ΘΜ
Δέ‘ΎΉΣ“Τ“ΚΧε«Α–η“ΣΉΔ“βΒΡ «(»ίΝΩΤΩ“―≤鬩«“œ¥Β”Η…ΨΜ)________________________ΘΜ
Δήœ¬Ν–≤ΌΉςΜα Ι≈δ÷ΤΒΡœΓΝρΥαΈο÷ ΒΡΝΩ≈®Ε»ΤΪ¥σΒΡ «________ΘΜ
AΘ°»ίΝΩΤΩ”Ο’τΝσΥ°œ¥Β”Κσ≤–Ντ”–…ΌΝΩΒΡΥ°
BΘ°ΝΩ»Γ≈®»ή“ΚΕΝ ΐ ±―ω ”ΩΧΕ»œΏ
CΘ°“Τ“Κ ±≤ΘΝßΑτ‘ΎΩΧΕ»œΏ“‘…œ
DΘ°Ε®»ίΙέ≤λ“ΚΧε ±Η© ”ΩΧΕ»œΏ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΩßΖ»ςΖΥαΨΏ”–ΫœΙψΖΚΒΡΩΙΨζΉς”ΟΘ§ΤδΫαΙΙΦρ Ϋ»γœ¬ΆΦΥυ ΨΘΚ

ΙΊ”ΎΩßΖ»ςΖΥαΒΡœ¬Ν––π ω’ΐ»ΖΒΡ «(ΓΓΓΓ)
AΘ°Ζ÷Ή” ΫΈΣC16H13O9
BΘ°1 molΩßΖ»ςΖΥαΩ…”κΚ§8 mol NaOHΒΡ»ή“ΚΖ¥”Π
CΘ°Ρή ΙΥα–‘KMnO4»ή“ΚΆ …ΪΘ§ΥΒΟςΖ÷Ή”ΫαΙΙ÷–Κ§”–ΧΦΧΦΥΪΦϋ
DΘ°”κ≈®δεΥ°ΡήΖΔ…ζΝΫ÷÷άύ–ΆΒΡΖ¥”Π
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com