
分析 (1)依据反应物和生成物配平书写化学方程式,根据定律关系判断,0.4mol液态肼和0.8mol H2O2混合恰好反应,所以1mol液态肼完全反应放出641.75kJ的热量;
(2)H2O(l)=H2O(g)△H=+44kJ/mol;依据盖斯定律计算分析得到;
(3)依据产物判断生成物质无污染;
(4)①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1 ②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1 ,则利用盖斯定律,将①×2-②×3可得氨气与氧气的热化学方程式.
解答 解:(1)反应方程式为:N2H4+2H2O2=N2+4H2O,0.4mol液态肼放出256.7KJ的热量,则1mol液态肼放出的热量为$\frac{256.7kJ}{0.4}$=641.75kJ,
所以反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol,
故答案为:N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.75kJ/mol;
(2)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.75kJ/mol;②H2O(l)=H2O(g)△H=+44kJ/mol;
依据盖斯定律①-②×4得到N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.75KJ/mol,
16g液态肼物质的量=$\frac{16g}{32g/mol}$=0.5mol,
所以16g液态肼与液态双氧水反应生成液态水时放出的热量是408.875KJ,故答案为:408.875;
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物为氮气和水,是空气成分不会造成环境污染,
故答案为:产物不会造成环境污染;
(4)已知:①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1 ②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
则利用盖斯定律,将①×2-②×3可得
常温下氮气与水反应生成氨气与氧气的热化学方程式为2N2(g)+6H2O(l)=4NH3(g)+3O2(g)
△H=2×(-92.4kJ•mol-1)-3×(-571.6kJ•mol-1)=+1536kJ•mol-1,
故答案为:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1536kJ•mol-1.
点评 该题考查热化学方程式的书写、反应热的计算,是高考中的常见题型,试题基础性强,难易适中.该题结合火箭发射,有利于培养学生学习化学的兴趣,有利于调动学生的学习积极性.


科目:高中化学 来源: 题型:选择题
| A. | 当光束通过下列分散系:有尘埃的空气、豆浆、墨水都能观察到丁达尔效应 | |
| B. | 溶液、胶体、浊液的根本区别是分散质微粒直径的大小 | |
| C. | 把1mL0.1mol/L三氯化铁溶液滴加入20mL沸水中,边加边振荡,可制得氢氧化铁胶体 | |
| D. | 胶体的稳定性介于溶液和浊液之间,属于介稳体系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-的物质的量 | B. | c(H+) c(OH-) | C. | c(NH4+) | D. | c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷是直链烃,所以分子中3个碳原子也在一条直线上 | |
| B. | 丙烯所有原子均在同一平面上 | |
| C. | 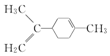 所有碳原子一定在同一平面上 所有碳原子一定在同一平面上 | |
| D. |  至少有16个原子共平面,至少8原子共线 至少有16个原子共平面,至少8原子共线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3 | |
| B. | CO2与Ba(NO3)2溶液不反应,SO2与Ba(NO3)2溶液也不反应 | |
| C. | CO2是直线型分子,推测CS2也是直线型分子 | |
| D. | NaCl与浓H2SO4加热可制HCl,推测NaBr与浓H2SO4加热可制HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点-54.1℃,沸点69.1℃.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点-54.1℃,沸点69.1℃.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑦⑧ | B. | ①④⑦⑧ | C. | ①⑥ | D. | ①④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,3.01×1023个CCl4所占的体积约为11.2 L | |
| B. | 80 g NH4NO3晶体中约含有NH4+ 6.02×1023个 | |
| C. | 3.9 gNa2O2吸收足量的CO2时转移的电子数约是3.01×1022 | |
| D. | 46 g NO2和N2O4混合气体中含有原子数约为1.806×1024 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com