
 氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点-54.1℃,沸点69.1℃.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点-54.1℃,沸点69.1℃.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:分析 (1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
平衡常数只受温度影响,将化学平衡常数K增大,应使平衡向正反应移动,该反应正反应是放热反应,故应降低温度,化学反应速率降低,据此解答;
(2)提高反应中Cl2的平衡转化率,改变条件使平衡向正反应移动,根据平衡移动原理结合选项分析解答,注意不能只增大氯气的用量;
(3)增大氯气的浓度,平衡向正反应移动,反应为可逆反应,反应物不能完全反应,平衡时37Cl存在37Cl2和SO237Cl2 中;
(4)达到平衡状态时,正逆反应速率相等,各物质的浓度不变,百分含量不变,以及由此衍生其它一些物理量不变,据此结合选项判断.
解答 解:(1)常温常压下SO2(g)+Cl2(g)?SO2Cl2(l)的平衡常数K=$\frac{1}{c(S{O}_{2})•c(C{l}_{2})}$,
平衡常数只受温度影响,将化学平衡常数K增大,应使平衡向正反应移动,该反应正反应是放热反应,故应降低温度,化学反应速率降低,故不能实现K增大的同时化学反应速率v正增大,故选d,
故答案为:$\frac{1}{c(S{O}_{2})•c(C{l}_{2})}$;d;
(2)提高反应中Cl2的平衡转化率,改变条件使平衡向正反应移动,不能只增大氯气的用量,
a.缩小容器体积,压强增大,平衡向正反应移动,Cl2的转化率增大,故a正确;
b.使用催化剂,缩短到达平衡的时间,不影响平衡移动,Cl2的转化率不变,故b错误;
c.增加SO2浓度,平衡向正反应移动,Cl2的转化率增大,故c正确;
d.该反应正反应是放热反应,升高温度,平衡向逆反应移动,Cl2的转化率降低,故d错误;
故答案为:ac;
(3)增大氯气的浓度,平衡向正反应移动,反应为可逆反应,氯气不能完全反应,故平衡时37Cl存在37Cl2和SO237Cl2 中,
故答案为:c;
(4)a.υ(Cl2)=υ(SO2),没有指明正、逆速率,无法判断,故a错误;
b.随反应进行,气体的物质的量减小,压强减小,容器中气体压强不随时间而变化,说明达到平衡,故b正确;
c.平衡时氯气与二氧化硫的浓度与起始浓度有关,起始浓度不同,平衡时二者浓度不同,若二者起始浓度相同,用于二者按1:1反应,故任意时刻二者的浓度都相同,故c(Cl2):c(SO2)=1:1不能说明达到平衡,故c错误;
d.容器中气体颜色不随时间两变化,说明氯气的浓度不再变化,说明达到平衡,故d正确;
故答案为:bd.
点评 本题考查化学平衡常数、影响反应速率的因素、化学平衡状态的判断、化学平衡影响因素等知识,为高频考点,侧重于学生的分析能力的考查,难度中等,(1)注意平衡常数表达式中固体、纯液体不需要写出.


科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | △H>0表示产物的总能量低于反应物的总能量 | |
| C. | △H 的单位kJ•mol-1,热量Q的单位为kJ | |
| D. | 化学键断裂过程中释放能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
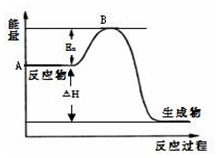 2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答:
2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑦ | B. | ①⑤⑥ | C. | ②③④⑦ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质不一定能导电 | |
| B. | 氨溶于水得到的氨水能导电,所以氨水是电解质 | |
| C. | 将硫酸钡放入水中不能导电,所以硫酸钡是非电解质 | |
| D. | 在水溶液或熔融状态下能导电的物质叫做电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 现用0.02500mol/L的标准盐酸溶液滴定某未知浓度的氢氧化钠溶液,有关数据记录如表:
现用0.02500mol/L的标准盐酸溶液滴定某未知浓度的氢氧化钠溶液,有关数据记录如表:| 序号 | 待测液体积(ml) | 所消耗标准盐酸的体积(ml) | ||
| 滴定前 | 滴定后 | 消耗体积 | ||
| 1 | 25.00 | 1.00 | 27.30 | 26.30 |
| 2 | 25.00 | ? | ? | ? |
| 3 | 25.00 | 1.50 | 27.84 | 26.34 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com